図8.1 外来種導入案の評価のための検討・決定モデル
レイモンド・A・ジリンスカス
メリーランド大学バイオテクノロジー研究所バイオテクノロジー社会問題センター(米国メリーランド州カレッジ・パーク)
はじめに
バイオテクノロジーが開発され、進歩するにつれて、遺伝子工学の手法を使って生み出される生物・無生物の産物の数や種類は増加の一途をたどることになる。こうした産物のほとんどは陸上で試験、使用されることになるが、なかには水中環境で利用されるものもある。必然的に、2つの疑問が生じてくる。遺伝的に改変された水生生物は、リスク評価や規制を行う当局にとって特別な、あるいは固有の問題を引き起こすだろうか。バイオテクノロジーによって作られた無生物の産物を海中で使用した場合、特別なリスクはあるだろうか。こうした疑問に回答することが重要なのは、国民の健康や環境衛生を保全するためだけでなく、リスクがある場合には、適切な管理の手続きや規制を定め、実施しなければならないからである。
本章の目的は、これらの疑問に答えること、つまり、遺伝的に改変した(以下、トランスジェニックという)水生の動植物や無生物のバイオテクノロジー産物が、ヒトや環境に特別なリスクをもたらすかどうかを判断しようということである。この判断を行うためには、4つの問題を検討しなければならない。第1に、トランスジェニック水生微生物や、トランスジェニック生物に由来する加工産物の用途として、どのようなものが考えられるか。第2に、トランスジェニック水生動植物の放出に関する基準、ガイドラインあるいは手続きがあるか、あるとすれば、その内容と範囲はどのようになっているか。第3に、トランスジェニック水生動植物の使用や放出を管理することを目的とした封じ込めその他の軽減措置がとられているか、とられているとすれば、それはどの程度有効か。第4に、トランスジェニック水生微生物や遺伝子組換え産物の使用や放出に関するリスク評価体系が確立しているか、確立しているとすれば、それはどの程度有効か。
そこで、以下の4つの節ではそれぞれの問題を順に扱う。まとめの節では、それまでの節で得られた知見をまとめ、バイオテクノロジーが水中環境に適用された場合に、研究者、リスク評価担当者、規制当局を悩ませる安全上の問題を引き起こすか、あるいは引き起こす可能性が高いかどうかを判断する。
トランスジェニック水生微生物およびトランスジェニック生物由来の産物の利用可能性
水産バイオテクノロジーは、「モノやサービスの提供を目的として、材料を水生生物学的因子によって加工するのに、科学・工学の原理を応用すること」と定義することができ、バイオテクノロジー一般のなかでも急速に発展・成長している分野の1つである(Zilinskas et al., 1995)。世界銀行による研究でも述べられているように、この分野は沿岸や島嶼の途上国にとって特に有望な利用分野である(Zilinskas & Lundin, 1993)。遺伝子改変水生動植物の最大の利用分野は、少なくとも短・中期的には、水産養殖になるだろう。トランスジェニック生物由来の産物は、動物衛生、バイオレメディエーション、防汚への利用など、水中環境でさまざまな用途があると考えられる。
トランスジェニック水生微生物の用途
トランスジェニック水生微生物の研究、開発および利用の可能性については、多くの論文が著されている(Renn, 1986; Colwell, 1987; Chen & Powers, 1990; Powers et al., 1991; Chen et al., 1992; Devlin & Donaldson, 1992; Hallerman & Kapuscinski, 1992; Donaldson & Devlin, 1993)。これら一連の論文の内容を分析すると、トランスジェニック水生微生物の開発は、6つの性質を向上させるために行われることがわかる。
1. 代謝―代謝経路に対する遺伝的制御機構を改変して、成熟の促進、より大型の成体の獲得、生殖率の向上、体組織における脂肪量の減少、栄養利用の効率化を行うことができる。たとえば、すでにこの分野の研究の成果として、マスの成長ホルモン遺伝子を含むトランスジェニックのコイやナマズが開発されており、これらのトランスジェニック生物は、野生近縁種よりも早く、大きく成長する(Chen
& Powers, 1990)。
2. 生理機能―生物の生理学的性質を改変することによって、水温の高低、塩分濃度の高低、金属濃度や汚染の高さ、溶存酸素濃度の低さへの耐性を向上させることができる。関連研究の一例として、カナダでは、10℃以下の低水温で生育できるようになる北極カレイ由来の不凍化タンパク質をコードする遺伝子を含むトランスジェニックサケを開発する試みが行われている(Shears
et al., 1991)。
3. 生化学―水生植物種を改変して、医薬品や特殊化学品として有用な物質を過剰産生させることができる。例として、野生種よりもカラギーナンを大量に産生するトランスジェニックの大型藻類の開発(Robinson,
1985)や、養殖の大型藻類によるβ-カロテンその他の特殊化学品の産生を増加させる(Brown et al.,
1989)プロジェクトがいくつか進行中である。
4. 定着―大部分の軟体動物種の稚貝は、定着して、表面で生育するようになる前に特殊な化学的信号を必要とする(Morse,
1991)。水産養殖における有用種の稚貝を養殖業者の望みの場所と時期に定着するように改変することができれば、水産養殖の作業効率は大幅に向上する。
5. 病害抵抗―生物の免疫防御機構を改変して、産生するサイトカインの量を増やしたり種類を変えること、一般的な病原性の細菌やウイルス、菌類に対して産生される抗体の濃度を高めること、免疫強化剤を産生させることによって、生物の感染症への抵抗性を高めることを目的とした研究が考えられる。水生脊椎動物や水生無脊椎動物の免疫機構についてはほとんどわかっていないため、現在のところ、こうした研究目標は理論上でのことである。
6. 行動生物学―水産養殖によって成長した種には、その卵や稚魚を食べるという有害な形質を持つものがあるため、たとえば、養殖動物で分泌されるホルモンの量や種類を遺伝的に改変して行動様式を変えることを目的とした研究が考えられる。この分野での利用が想定できるようになるには、それ以前に基礎研究によって魚類や貝類の行動の生物学的根拠を明らかにする必要がある。
遺伝子工学による産物の水中環境での用途
遺伝子組換え生物に由来する無生物産物は、陸上環境では人や動物の健康の向上、有毒な汚染物質の除去、農業の拡大などさまざまな目的に利用されている。水産バイオテクノロジーは、「陸上の」バイオテクノロジーに比べて少なくとも10年は遅れているため、この分野の研究を基にした利用は、短期的にはわずか3例しか見込むことができない。それは、水産動物衛生、バイオレメディエーション、バイオフィルムやバイオ接着である。
動物衛生
バイオテクノロジーによって、水生生物がよく罹る細菌性、ウイルス性の疾患に対する特殊なワクチンを作ることができる(Meyer,
1991)。ワクチンは、現在、アジアや南アメリカでたびたび水産資源を死滅させ、巨額の被害をもたらしている病気から魚や小エビなどの水産養殖生物を保護する(Arthur
& Sheriff,
1991)。たとえば、伝染性造血器壊死症(IHN)からサケを守るワクチンを開発しようという研究はかなり進んでいる。実験段階では、3種類のワクチンの試作品が開発され、試験されている(Powers,
1990)。この3種類はすべて、注射によって魚をIHNウイルスから保護するものである。ただし、最初のタイプ(従来型の死菌ワクチン)は、水中で投与すると効果がないことが判明した。2番目のタイプは弱毒化した生ワクチンで、水中で接種しても有効だったが、安全性に関する疑問が解消されていない。3番目のタイプは組換えワクチンの一種で、有効性、安全性、価格の面でもっとも有望である。これは、米国、オレゴン州立大学の科学者グループの研究から生まれたもので、このグループは、魚の抗体産生を誘導するタンパク質をコードする複数の遺伝子を同定して性質を調べ、クローニングを行った。タンパク質のなかには、高いレベルで発現しているものがある(Engleking
& Leong, 1991)。現在、この候補ワクチンは、生産が拡大され、野外試験のための承認を米国農務省(USDA)に申請中である。
ワクチン以外にも、保護機能を持つ物質はあるかもしれない。たとえば、甲殻類のEcteinascidia
turbinataからの抽出物の1つは、ウナギをエロモナス(Aeromonas)属の細菌の感染から守り、また一般に、ワタリガニ、ザリガニ、クルマエビの免疫学的防御機構を高める(Colwell,
1986)。より実際的な例として、ノルウェーのフィリップス石油は、酵母から得られるグルカンでマクロガード(Macrogard)という同社の製品が、ワクチンの有効性を高め、養殖魚に病害抵抗性を持たせるのに役立つと主張している(Hoffman,
1990)。
バイオレメディエーション
バイオレメディエーションとは、微生物やその産物を利用して、土壌中または水中の汚染物質や廃棄物を、無害あるいは毒性の少ない最終産物に分解することである。バイオレメディエーションは環境への有害性が比較的低いため、汚染区域を浄化するために物理的または化学的な強力な処理方法に頼る従来の手法に比べて大きなメリットを持つ。その技術が完成されるにつれて、バイオレメディエーションは汚染された港や水路その他の構造物の浄化および入り江やマングローブなどの敏感な沿岸生態系の汚染除去に好んで用いられる手法になる可能性がある(Holloway,
1991)。
本章では微生物を扱わないため、微生物によるバイオレメディエーションに関心のある読者は、バイオ処理に関する第9章(モリス・レヴィン著)のほか、米国技術評価局が公表した海洋油流出のバイオレメディエーションに関する報告書(OTA,
1991)を参照してほしい。ただし、バイオレメディエーションの手法で用いられる可能性のある無生物の微生物産物には2種類ある。それは、分散剤と界面活性剤である。分散剤には、流出した油を小さな油の粒子に分解する作用があり、そうした油の粒子は水面から水柱や海底に簡単に移すことができる。分散した油はかたまりの油よりも微生物の攻撃を受けやすいため、分散剤は微生物によるバイオレメディエーションを促進するのである。界面活性剤は、油と水の境界の界面張力を低下させ、油を水中で乳化させることができる。細菌が産生する界面活性剤は、一般に毒性がなく生分解性である。一例として、プリンス・ウィリアム湾での実験では、緑膿菌(Pseudomonas
aeruginosa)の産生する生物界面活性剤(バイオサーファクタント)によって、海岸の砂や岩からの油の除去率が向上したことがわかった(Harvey
et al., 1990)。海洋微生物のAcinetobacter calcoaceticusからは、エマルサン(Emulsan)という別のバイオサーファクタントが単離されている。これは、タンカーをはじめ船の油貯蔵タンクの洗浄に幅広く利用されている。エマルサンは、油田での油回収の向上や汚染防止への利用もテストされている(Weiner,
1985)。
バイオフィルムまたはバイオ接着
天然の水に何かを沈めると、かならず水中微生物が棲みつき、そこに付着するための付着性の物質を分泌し、膜を形成する。まもなく、微生物がコロニーを形成した表面に海生植物や無脊椎動物が引き寄せられ、これらもまた、こびりついたようになって棲みつく。この付着物に絡まった生物は酸を産生し、この酸が桟橋や油井やぐらなどの構造物を腐食させる。また、こびりついた付着物によって船の船体の抵抗が増加し、操業コストを20から40%増加させている(Costerton
& Lappin-Scott,
1989)。現在は、重金属を含む塗料を使って露出した表面をコーティングし、微生物を追い払って定着を防いでいる。しかし、こうした塗料は作業者にとって有毒であり、海水を汚染する。
水産バイオテクノロジー研究では、この定着や付着の過程を分子レベルで明らかにしようとしており、その知見は、海洋生物が船舶や海中の構造物に定着するのを防ぐクリーンな手法を開発するのに利用することができる。たとえば、研究によって、コロニーを形成する生物を寄せつけず、定着を妨げる無毒のフィルムの開発につながる可能性もある。反対に、こびりつきを形成する生物が表面に付着するために分泌し、使っている粘着性物質は、水中やその他の湿った場所で固まる強力な接着剤として利用することが可能なため、産業的にも興味深い(Strausberg
& Link,
1990)。実際、イガイ類や二枚貝の粘着性物質の産生をコードする遺伝子がクローニングされ、産業用微生物で発現させることが行われている。すでに、こうした海洋性の粘着性物質は、水中の構造物を接着したり、ガラスカラム内の培地に固定化微生物を固定するのに使われている。また、海洋性の粘着性物質は、整形外科手術における骨の接着や歯科技術における歯の移植など、人への利用も試験されている(Strausberg
& Link, 1990)。
水生環境におけるトランスジェニック水生動植物や無生物産物の使用または放出に関する基準、ガイドライン、手続き
現在までのところ、トランスジェニックの水生動植物の水生環境での使用や放出に関する基準、ガイドライン、手続きが存在しないのは間違いないといえる。これは、水産バイオテクノロジーが開発の初期段階にあり、実用段階に達している製品がわずかしかないためだと思われる。つまり、将来のいつかわからない時期に起きるかもしれない行為や、さらには、いまのところ内容がはっきりしない行為のリスクを評価しようという理由はほとんど見いだせなかったのである。しかし、先に述べたように、遺伝子改変生物由来の産物はまもなく実用化されて湖や海洋に影響を及ぼす可能性があり、科学者たちが開放系の水生環境でのトランスジェニック魚の試験の許可を求めるようになるため、今後2、3年のうちにこの状況は変わるのは間違いないだろう。こうした将来の1つの徴候として、すでに2種のトランスジェニック魚の試験が、閉鎖系の野外池で行われている。これらの試験が成功すれば、開発者が次に行おうとするのは、より現実的な、開放系の水生環境での試験だと思われる。
水産バイオテクノロジーや水生環境に関連するバイオテクノロジー開発に限定した基準やガイドライン、手続きとして参考にできるものがないため、バイオテクノロジー一般の歴史と実績を検討することによって、こうした活動によって生じているバイオセーフティーの問題を明らかし、それらを軽減するためにとられた規制措置を検討する必要がある。
最先端のバイオテクノロジー研究によって、無生物の産物とトランスジェニック生物という2つのタイプの産物が生みだされる可能性がある。これら2つの分野のそれぞれが、規制当局に重要な問題をもたらす。すなわち、遺伝子改変生物によって産生される無生物産物は、従来の手法で得られた産物を上回るリスクをヒトをはじめとする動物や植物にもたらすだろうか。トランスジェニック動植物を水生環境へ意図的に放出することによって、既存の生命体あるいは環境そのものに危害を生じるだろうか。
最初の遺伝子改変産物が評価のために提示された1981年以降、遺伝子工学による無生物産物に関して国内の規制当局や国際機関が得た大きな教訓が2つある。第1に、産物を得たプロセスには、従来プロセスによって生じる問題を上回る問題はない。すなわち、ある特定の工業発酵プロセスに用いられるのが、遺伝子改変微生物か伝統的な育種・選択を通じて生みだされた微生物かはほとんど問題ではなく、どちらの事例に対しても同様の優良製造・安全規範があてはまる。第2に、遺伝子改変産物の試験は、従来手法による産物の試験と異なっている必要はなく、安全性と有効性に関する同じ基準をどちらにも等しく適用する。そのため、遺伝子工学によって得られた無生物産物に対する規制を政府が制定または採用している国なら世界中どこでも、規制の状況は同じということである。見たところ、無生物のバイオテクノロジー産物に対象を特化した規制を実施している国はなさそうである。さらに、EUの諸機関、経済協力開発機構(OECD)、世界保健機構(WHO)といった国際機関によって定められたバイオセーフティーに関する規制や制度、ガイドラインでは、先端バイオテクノロジーによる無生物産物を、従来の研究開発によって得られる産物を扱うのと同じ方法で扱っている(OECD,
1986)。この点を示すため、OECDでは、こうした基準に基づいたバイオテクノロジー・ガイドラインを加盟国向けに作成している(OECD,
1986,
1992)。同様に、国連食糧農業機関(FAO)、国連環境計画(UNEP)、国連工業開発機関(UNIDO)およびWHOが共同で設置した機関間作業部会は、途上国が国内法のモデルとして利用することを想定した一連のガイドラインを作成した(UNIDO,
1992)。ただし、繰り返しになるが、水産バイオテクノロジーあるいは無生物産物の水生環境での利用に伴うリスクを特に対象とするガイドラインはない。
第2の問題は、生きたトランスジェニック生物の意図的放出に関するもので、現在、科学界や国民から大きな注目を集めている。意図的放出には、導入された生物が環境やそこに生息する動植物などに直接に害を及ぼす可能性と、導入生物のゲノムに由来する1つないし複数の遺伝子が伝播し、標的外の生物のゲノムに組み込まれる可能性という2つの主なリスクがある。こうした懸念とリスク評価の制度についてはP.149〜157で解説、検討する。
水生環境へのトランスジェニック生物の放出の防止または管理
トランスジェニック動植物の水生環境への放出を防止または管理するために、封じ込めその他の軽減措置を定めている政府や国際機関はないようである。そういう状況であれば、トランスジェニック水生動植物に関する今後の制度について、教訓を引き出せるような類似の状況がないかを検討することが有用である。
外来の海洋動物の拡散、つまり、水生動植物が通常の生息場所から別の環境へ持ち込まれている状況を管理した世界各地での経験をみると、今後、別のタイプの外来生物、すなわちトランスジェニックの水生動植物の導入に関連して問題が生じうると考えられる。つまり、過去に水生生物が新たな区域に導入された際の事例から情報を得ることができ、この情報をもとに、今後行われるトランスジェニック水生生物の野外試験に伴うリスクを明らかにし、そのリスクが現実のものとなる可能性を評価し、リスクを軽減し、除去するための手法を考案することが可能なのである。したがって、過去に起きた自然の、または人為的な拡散を検討してそこから何を知ることができるかを検討し、導入による損害の防止や管理をするために行われた国内および国際的な試みを評価しなければならない。
水生種の拡散
種の拡散が自然に起きる際のもっとも一般的なメカニズムは、分布域の拡大である(Mann & Rosenfield,
1992)。この現象を明らかにすることを目的とした科学研究はほとんど行われていないため、これについてはよくわかっていない。つまり、別の区域への導入が検討されている水生生物の分布域が拡大する可能性については、予測することができない。水生種の新たな区域への意図的な導入案に伴うリスクを評価しようとする審査当局にとって、分布域拡大に関する科学的データが不足していることが問題なのは明らかである。問題の生物が国外からきたものでも遺伝子工学的に作られたものでも、分布域の拡大に関する不確定性は同じように存在するため、両者の違いはほとんどないと思われる。
水生種の人為的な拡散とは、種がそれまでまったく存在していなかった生息場所に、人の活動によって意図的あるいは偶発的に導入されることである。人の活動による外来種の偶発的な導入が始まったのは、おそらく人類が航海を始めた時からで、生物は船のバラストの中や(Aquatic
Nuisance Species Task Force, 1992; Carlton,
1992a)、木製の船体にこびりついたり入り込んだりして(Peterson,
1992)、ある場所から別の場所へと運ばれたのである。大洋と大洋あるいは湖と湖をつなぐ運河によって船の航行域が拡がり、それと同時に生物にとっての新たな移動経路が開かれた。貿易業者らは、甲殻類、魚類、軟体類を漁場から遠く離れた市場へと送ってきた。それと一緒に、こうした魚介類に感染する病原体も運ばれてきた(Carlton,
1989)。自分の水槽で観賞魚などの生物を飼育している人々は、地元の水路にそれらを放流して処分している(Andrews,
1992)。海を越えた貿易が始まって以来、世界中で数千に及ぶ水生種が、数え切れないほどの方法で、偶発的に移動させられており、またその結果、たしかな割合はわからないものの、かなりの割合が新たな生息地でコロニーを形成するのに成功していることは、容易に想像できる。
偶発的な導入や移動の原因を作っていることに加えて、貿易業者はあらかじめ何らかの意図を持って水生植物を原産地である区域で捕獲し、別の区域に移動させてもいる。外来水生種の意図的な導入が行われるのは、陸上での動植物の意図的な導入と同様、ほとんどの場合、水産養殖や漁業を発展させるためだが、場合によっては、環境に影響を及ぼす目的のこともある(Welcomme,
1986; Stickney,
1992)。1950年代と1960年代には、第三世界の各地で水産養殖の向上や確立のために魚類や甲殻類の大規模な導入が行われたが、アフリカ産テラピアのアジアや南米への導入、インド産の大型コイの東南アジアや南米への導入、ブラックタイガー(Penaeus
monodon)やコウライエビ(P. orientalis)の多くのアジア諸国および一部の南米諸国への導入などがその例である。環境上の目的での意図的導入の例としては、マラリアが風土病である地域に蚊の幼虫を好んで食べる魚類種のカダヤシ(Gambusia
affinis)やグッピー(Lebistes reticulatus)が導入された例や、水生植物の過剰繁殖を抑えるのに使われるソウギョ(Ctenopharyngodon
idelle)が、熱帯や亜熱帯の各地の運河をはじめとする数百の水路に導入された例がある。
1970年代の終わりから1980年代の始めにかけては、シマスズキ(Morons saxatilis)の米国西海岸地域への導入、マガキ(Crassostrea
gigas)の米国やカナダの西海岸地域およびフランスへの導入、サケ類(Oncorhynchus属)の大西洋海域への導入、カラフトマス(O.
gorbuscha)の旧ソビエト連邦の北極海沿岸海域への導入、パナマ産エビ類(P. stylirostris)のハワイへの導入、ワカメ(Undaria
pinnatifida)のフランスへの導入などがある(Sindermann, 1986; Welcomme,
1986)。もっと最近では、1989年に大型藻類のEuchema spinosumがフィリピンからジンバブエに運ばれ、現在ジンバブエではこれが養殖、収穫、乾燥されて欧州に輸出され、欧州で食品添加物用の多糖類が抽出されている(Zilinskas
& Lundin, 1993)。
こうした導入の多くは地元の住民に恩恵を与え、受け入れ国の経済を向上させてきた。しかし、陸上に導入される種と同様、導入された水生種の一部は、ほとんど目に見えないものから深刻なものまでさまざまな程度のダメージをもたらしている。たとえば、カダヤシは蚊の幼虫を好んで餌にする一方で、他の魚の卵や養魚も食い尽くしてしまう。ソウギョは、他の魚種に病害をもたらす条虫を媒介する。海草のタマハハキモク(Sargassum
muticum)は、マガキと一緒に不注意によって導入され、ついには英仏海峡に面した英国とフランスの海岸に沿って密生して、輸送活動やレジャー活動の妨げになりはじめた。大規模に導入されているエビのP.
vannameiは、伝染性皮下造血器壊死症ウイルスと呼ばれる病原体を保持しており、このウイルスが太平洋沿岸各国の養殖施設に広がって、エビ資源を死滅させている。
拡散による損害の原因と影響については、多くの文献で取り上げられている。水産養殖一般に関する問題を検討、分析したもの(Carlton,
1992b; Courtenay & Williams, 1992; Davidson et al.,
1992)もあれば、水生植物(Neushul et al., 1992)、軟体類(Farley, 1992)、甲殻類(Kern &
Rosenfield, 1992; Lightner et al., 1992)、魚類(Ganzhorn et al., 1992;
Thorgaard & Allen,
1992)などのより専門的な分野の問題を論じたものもある。過去の人為的な拡散による影響を分析すると、導入が偶然によるものか意図的な導入の際の不注意によるものかを問わず、6つの教訓が得られる(Zilinskas
et al., 1995)。
1.
導入された動物は、競争や捕食によって現地の動物相を破壊することがある。最悪の場合、導入された外来種が、1つ以上の野生種を全滅させる可能性もある。
2.
導入種は、導入された生息地の一部にダメージを与え、破壊することがあり、それによって自然のバランスが崩れ、現地の環境の劣化や破壊につながる可能性がある。
3.
場合によっては、新たな場所に導入された種が遺伝的劣化を受ける可能性がある。つまり、新たな場所に生息している野生種と導入された種が交雑すると、持っている望ましい遺伝的性質の一部が失われたり劣化したりすることがある。
4.
その反対に、外来種が導入された場所に生息している野生種が、遺伝的劣化を受ける場合もある。たとえば、導入種が在来の野生種と交雑すると、野生種が定着のために進化させてきた適応力が、雑種の後代では弱まったり、失われたりすることもありうる。さらにひどい場合には、外来種が野生種を追い払ったり取って代わったりして、重要な遺伝子が失われる可能性もある。
5.
導入種は、それ自体が招くリスクに加えて、感受性のある在来種に感染力のある外来の病原体を運んだり含んでいる場合がある。新たに導入された病原体は、宿主生物によって生じるダメージとは量的にも質的にも異なるダメージを引き起こす可能性がある。
6. いったん導入種がある場所でコロニー形成に成功すれば、それが固有種になって排除することが不可能になる場合もある。
水生種の導入の歴史から一般的な教訓が得られるとすれば、それは、北米へのカワホトトギスガイの導入のように、偶発的な導入のほうが、意図的な導入よりも大きなダメージを引き起こしていると思われる一方で、アフリカの湖の窮状が示すとおり、意図的な導入もまた、国内や地域の生息地に甚大な損害を与えている、ということだろう(Baskin, 1992)。さらに、われわれの予測能力は、導入を検討している種が在来種や環境にほんとうに直接的・間接的にダメージを与えるかどうかを前もって判断したり、導入によって生じる損害費用が最終的な便益を上回るかどうかを事前に判断できるほど、高度ではない。
外来水生生物の拡散の管理
世界各地で水生生物の拡散が起きているため、多くの政府が管理のための措置を採用・実施している。政府間組織や非政府組織によって定められたガイドラインが、国内法のベースとなっている場合もある。水生生物の拡散を管理しようという国内および国際的な措置を概観することは有用である。
導入を管理するための国内措置
オーストラリア(McKay, 1984)、カナダ(Crossman, 1984)、メキシコ(Contreras-B &
Escalante-C, 1984)、ニュージーランド(McDowall, 1984)、オセアニア(Maciolek,
1984)、プエルトリコ(Erdman, 1984)、米国(Zilinskas et al.,
1995)での外来魚の導入に関する情報を検討すると、その影響や導入による損害への政府の対応について、一般的な結論が3つ得られる。
第1に、あらゆる国や地域が、外来水生生物の意図的あるいは偶発的な導入によって、なんらかのマイナスの影響を被っていることは明らかである。しかし、メキシコなど調査が行われた国の一部では、導入の詳細な記録が残されておらず、またほとんどの国はそうした記録が全くなく、ごく基本的なデータしか記録されていないため、世界全体での導入の影響の全容を見極めることができない。
第2に、導入による1つないし複数の損害という明白な事実に直面した場合、各国政府は、導入によってそれ以上損害を受けないようにするための規則や法律を制定するという対応をとるのが普通である。こうした法律や規制は、2つのタイプに分かれる傾向にある。まず、意図的な導入に重点を置いた法律が制定され、しばらくして偶発的導入を防ぐための追加の法律が制定される。
第3に、意図的な導入の規制や管理を目的とした国内法は、導入案を却下する際の基準をいくつかあげている。却下を判断する基準として国内法に一般的にみられるものには、次のようなものがある。
1.
検討中の生物が、たとえば、繁殖の速さや栄養摂取の方法、あるいは導入場所で定着や拡散するという並はずれた能力を持っていること等によって、環境に被害を与えうることが証明されているかどうか。
2.
その生物が並はずれて食欲旺盛あるいは攻撃的かどうか。その生物が、たとえば、傷を負わせるような鋭い歯、有毒な棘、発電器官などによって、人や他の動物に危害を加える可能性がないかどうか。
3. その生物が、在来の個体群に悪影響を与える可能性のある病原体や寄生体を保持したり伝播したりする力がないかどうか。
偶発的な導入を防ぐための政府の取り組みは、いっそう困難なものである。通常、偶発的な導入によって破局的な結果が生じることがきっかけとなって、法律によって再発を防ごうとする試みが行われる。たとえば米国では、カワホトトギスガイの偶発的導入による被害が連邦議会を促して、1990年有害な外来水生生物の予防防除法とも呼ばれる連邦公法101−646を成立させた(Zilinskas et al., 1995)。この法律が成立したそもそものきっかけは、五大湖におけるカワホトトギスガイの大繁殖に対する議会の懸念だったが、法律には偶発的導入一般に対処するための措置の枠組みが規定されている。この法律には5つの目的がある。(1)バラスト水の管理などを通じて、米国の水域への外来種の導入および拡散を予防すること。(2)有害水生種、とりわけカワホトトギスガイに関する連邦政府支援の研究や予防措置の整合化を図ること。(3)バラスト水以外のルートによる外来種の非意図的導入を防止・管理するための規制措置を設けること。(4)外来種が定着した場合の影響を最小限に抑えること。(5)各州によるカワホトトギスガイの管理を支援するために国の計画を定めること(Kern & Rosenfield, 1992)。このほかの国々でも、偶発的導入を防止するために同様の法律を制定していると考えられる。
国際的措置
国際的なレベルでは、拡散に対処するためのいくつかの規範や規則が公表されている(Carlton, 1992c; Jacob, 1994)。重要な出来事として、1973年(その後1979年に改正)に国際海洋探査委員会(ICES)によって立案された規範である、「海洋種の導入および移動によって生じる悪影響のリスクを軽減するための改正行動規範」の採択がある。このほか、米国水産学会(1973年)、国連海洋法会議(1982年)、欧州評議会(1984年)、FAO・欧州内水面漁業諮問委員会(1984年)、国際自然保護連合(1987年)が、この問題に関する行動規範、基本声明、協定を発表している。こうした規範や声明の最も重要な目的は、将来の偶発的導入を防ぎ、意図的導入による悪影響の防止に向けて国際的な共同行動を取ることである。ただし、ここにあげた規範のうち、国家を法的に拘束するものは1つもない。
水生環境でのトランスジェニック動植物の使用または放出に関するリスク評価の方法
トランスジェニック動物や植物の水生環境での使用案または放出案に特有のリスクを判断するためのリスク評価の枠組みは、現在までのところ整備されていない。そうした状況なので、次の2つの節では海洋バイオテクノロジーを構成する2つの分野(一般的なバイオテクノロジーおよび海洋生物学)で用いられているリスク評価方式を検討し、さらに3つ目の節では、トランスジェニックの水生生物を対象に含めるために、それらをどのように組み合わせることができるかを示す。
バイオテクノロジーの利用の際に用いられるリスク評価の枠組み
米国学術研究会議(NRC)は、遺伝子組換えの微生物や植物の陸上環境での野外試験に関する問題を詳細に検討し、放出案に伴うリスクを評価する際には3つの基準が不可欠であると結論づけている(NRC, 1989)。
1. その生物の性質および生物が導入されようとしている環境について充分な知識があるか。
2. その生物を有効に封じ込めまたは管理することはできるか。
3. 導入される生物やそれが保持する遺伝形質が、意図したよりも長く定着し、標的外の生物に伝播した場合、環境にどのような影響が考えられるか。
OECDは、すでに1983年にはバイオテクノロジーの安全性の問題を検討し始めており(Teso, 1992)、1992年に遺伝子改変生物の野外試験に関するガイドラインを公表している(OECD, 1992)。その枠組みは、実質的にはNRCのものと同じで、リスク評価に不可欠な3つの基準が含まれている。しかし、水生生物の野外試験の安全性を評価する上で、OECDが立案した植物の野外試験の評価に関する独自の手法を見てみるのは有益である。これらの手法は陸上環境に関するものだが、今後、水生環境での野外試験のための枠組みが策定される際には、同じような手法が考案される可能性が高い。この独自の手法では、生物の生物学的性質や試験が行われようとしている区域を参考にする(OECD, 1992)。
生物の生物学的性質
ある植物種の野外試験に伴うリスクを評価する場合、その種の次のような性質が考慮されなければならない。
1. その植物の繁殖性と生物学的性質(開花、受粉の必要条件、種子の性質、試験区域と類似する環境で繁殖を管理した実績など)
2. 新たに獲得した有毒な性質の作用、持続性、劣化の形態
3. 植物にDNAを導入するのに用いた生物学的ベクターの性質
4. 他の種や生態系との相互作用の可能性
試験区域
安全性の評価に際しては、野外試験が予定される区域の次のような性質を考慮する必要がある。
1.
野外試験の安全な実施にかかわる、区域の生態学上、環境上の重大な問題点(水流のパターン、地下水面、風のパターンその他、試験区域に固有な気象学的、地球物理学的現象など)
2. 試験区域の規模(場合によっては安全地帯も含む)
3. 被験生物の影響を受ける可能性のある近隣または遠隔の生物相があるかどうかを考慮した試験区域の地理的位置
遺伝子組換え生物の野外試験を安全に実施するための具体的な方法は、まだ確定していない状態にある。この分野における米国での経験をみると、遺伝子組換え生物の野外試験実施案は、米国農務省、具体的には同省の動植物検疫局(APHIS)によって事例ごとに扱われている。
農務省によって実施案が検討される際にまず行われるのが、綿密な環境影響説明書の作成である。この説明書は、放出によって生じる直接・間接の影響を考慮して、健康面および安全面の懸念に対応するものである。ここでは、放出によって、環境やその生物相のいかなる側面にも重大な変更や危害が及ばないと考えられると結論するに足るたしかな証拠を示さなければならない。プロジェクトが環境に対して無視しうる程度の影響しかもたらさないと農務省によって評価された場合、その結果は、最終決定が行われる前に広く公表されて、国民やその代表が環境影響説明書を詳細に検討し、意見を述べる機会を与えられるようにする。農務省はこれらの意見を聞くほか、他の利害関係者が作成した説明書を考慮した上で、最終決定を行う。農務省と米国環境保護庁は、遺伝子組換え生物の野外試験の最終承認をこれまでに900件以上与えており、その大部分が植物に関するものである。現在までのところ悪影響はみられず、米国の枠組みは、少なくとも短期的には機能していると考えられる(Miller
et al., 1991)。
NRCやOECDの基準をみると、トランスジェニックの陸生動物の野外試験に関してはほとんど触れられていない。これは、通常、これらの封じ込めは容易で、たとえ逃げ出したり偶発的に放出された場合でも、試験中のトランスジェニック動物が簡単に拡散したり、危害を及ぼす可能性が低いからである。しかし、今後見込まれる水生動物の野外試験に関しては、そのようなのんきなことはいっていられない。水生生物を扱う場合、2つの理由によって懸念が生じる。第1に、大部分の水生生物が、数千から数百万の受精卵や卵を周囲の水に放出するという重要な繁殖特性を持っていることである。第2に、水はきわめて優れた担体の1つであり、生体やタンパク質性の遺伝物質にやさしい。また、ほとんどの水は一カ所にとどまっているわけではなく、河川は湖や海に流れ込み、海水は渦や海流や風によって動き回る。つまり、陸生動物を封じ込めるのに使われるバリアが、水生動物の封じ込めには使えず、同じよう再現できないため、代わりに新たな封じ込め系を考案し導入しなければならない。
数種の水生生物の形質転換が行われてきたが、そのうち野外試験が行われているのはトランスジェニックコイとナマズの2種だけである。この試験の技術的な側面は、次のとおりである。
試験中のコイは、普通のコイ(Cyprinus carpio)のサイズを小さくした変種でミラーカープ(mirror
carp)と呼ばれ、マスの成長ホルモン遺伝子をコードする遺伝子と、いわゆるラウス肉腫ウイルスのプロモーター(遺伝マーカー)の2種類の外来遺伝物質を導入することによって遺伝的に改変されている。トランスジェニックコイは、海洋バイオテクノロジーセンター(メリーランド州)、スタンフォード大学(カリフォルニア州)、オーバーン大学(アラバマ州)の科学者らのグループによって開発された(Chen
& Powers, 1990; Chen et al.,
1992)。1990年、このグループは米国農務省に計画案を提出し、9匹のトランスジェニックコイが産卵した50,000匹の稚魚を10の野外池で生育させることを許可するよう求めた。グループの計画は、3カ月後には稚魚の数を1つの池あたり300匹に減らし、これらを同定のために標識してさらに15カ月間調査するというものだった。その後、魚は性的成熟に達する前に処分されることになっていた。魚を飼育する池は、フェンス、網およびフィルターで充分に保護され、池と既存の水路の間に直接の連絡はないとされた。さらに、ハリケーンなどの自然事象によって試験区域の完全な状態が脅かされる場合には、試験中の魚は有毒化学物質によって速やかに処分することになっていた。
プロジェクト案に関する環境評価が実施されたのち(USDA,
1990)、その結果が一連の公聴会で示され、さらに、一般の利害関係者や市民団体からの意見や批判を受け付けたのち、農務省は、「重大な影響は見いだせない」という決定、すなわち、「トランスジェニックコイの実験による環境への重大なリスクはない(出所不明,
1990)」という判断を示した。1991年春のはじめに、農務省はこの実験を進めることを承認した。トランスジェニックコイの試験が実際に始まったのは、1991年6月である。数カ月後、新たに開発されたトランスジェニックナマズについて同様の野外試験計画が提出されたが、このナマズにはニジマス由来の成長ホルモン遺伝子が導入されていた(出所不明,
1991)。この案は、1992年初頭に農務省によって承認された(出所不明, 1992)。
本章の目的に照らして、トランスジェニックコイおよびナマズの試験条件とNRCによって定められた(そして事実上OECDにも認められた)3つの基準とを比較することは有益である。まず、科学的な面からいうと、コイとナマズはこれまでに広範な研究がなされており、性質が充分にわかっている。どちらの魚も、マスの成長ホルモン遺伝子の挿入によって、成長に関係するものを除いて、身体的な性質は変わらない。異種遺伝子によってこれらの魚の行動パターンが変わるかどうかは、もちろん、試験を通じて答えが出る疑問の1つである。試験は人為的に作られた閉鎖系で行われるため、トランスジェニック魚が導入される環境についてはわかっている。これらの理由から、第1の基準はおおむね満たされる。2番目に、犯罪行為によって故意に魚が放出されない限り、トランスジェニックのコイとナマズの試験が行われる環境では、拡散の可能性は排除することができる。したがって、第2の基準は確実に満たされる。つまり、被験生物は有効に封じ込められ、管理される。試験環境での定着や伝播はないため、第3の基準は適用されない。
トランスジェニックのコイやナマズの野外試験は、閉鎖環境で管理されているため、水生環境での実際の野外試験よりも閉鎖系での試験に近い。しかしながら、科学者たちは新たな試験領域(水生環境)に足を踏み入れたところであり、試験の対象そのものが独特であるため、これまで慎重な手法が取られてきた。これらの試験が成功し、現時点で別の方法を考える理由がなければ、今後の野外試験の要件は緩和することが可能である。陸生環境での野外試験が展開する過程では、こうした緩和措置が進んだが、おそらく水生環境においても同じことが起きると思われる。
水生種の導入案に関するリスク評価の枠組み
ICESの規範の実施状況が一律でないため、カール・シンダーマン博士は、今後の導入案を扱うためのいくつかの戦略を立案した(Sindermann,
1986,
1992)。この戦略の冒頭では、自然に水生動植物を導入した場合の管理に関する国際的な管理手法が不充分である点を取り上げている。この問題では、国連の諸機関や非政府組織が主導して、外来種の導入によって在来種や地域の環境に及ぶ可能性のあるダメージについて、国民や政策担当者、国の規制当局の担当者への教育を行うべきである。導入に伴う問題、あるいは導入によって生じる問題について、いったん国内当局が敏感になれば、確固とした規制の枠組みを整備して、無許可の導入を防止し、導入が許可された場合の実施条件を示すことが、最も国の利益になることをいちばん認識するのは当局のはずである。
本章に最もかかわりのある戦略として、生物の移動を管理するための地域的な取り組みが強調されており、この取り組みでは関係各国が統一性と連続性を徹底させる。ある政府がどのような手法を採用するにしても、その手法はICESの規範で定めた一般的な運用原則にしたがって実施されるべきである。これらの原則は、導入によるリスクは決してゼロではないという前提に基づいている。そうであれば、国による規制制度は、導入によって生じるリスクが最小限に抑えられるように立案されるべきである。リスクの削減には、特に、導入が計画されている生物の自然の生息地での研究を徹底的に行うこと、新たな種を導入する代わりに在来種を開発できないか評価すること、導入に際しては移動性の種より非移動性の種を優先させること、導入種の継続的なモニタリングのための仕組みを確立することなどがある。特に重要なのは、導入の前に、競争や捕食などの生態学的考察、ハイブリダイゼーションや遺伝子頻度の変更可能性などの遺伝的考察、導入種と在来種の相互作用などの行動学的考察、新たな伝染病が導入種と一緒に持ち込まれる可能性などの病理学的考察の検討を通じて、導入案の科学的意味合いが分析されることである(Sindermann,
1986, 1992)。
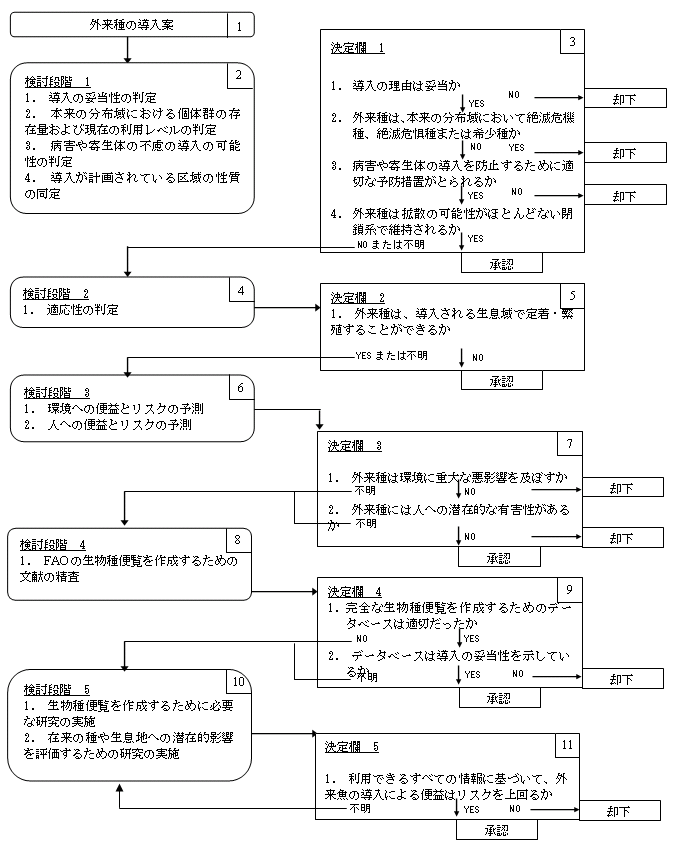
外来魚の導入案の評価を進める際の指針として、シンダーマンによって提案されたものより詳細かつ包括的な方法がKohler &
Stanley(1984)によって考案されている。この2人のアプローチは5つの検討段階に分かれており、段階が上がるごとにより多くのデータが要求される(図8.1参照)。評価プロセスは、具体的な導入案を検討するために設置される「外来魚実験計画委員会(Exotic
Fish Protocol Committee)」によって行われる。
検討の第1段階は、導入案の実行可能性を判断することである。導入種は、在来種によっては満たされないなんらかのニーズに応えるものになるか。導入種は将来のニーズに充分に応えることができるか。導入種の一部を除去することによってそれが脅かされるか。試験区域からの拡散の可能性はあるか。これらの基準の1つでも満たすことができない場合には、導入案は承認されるべきではないと思われる。
検討の第2段階は、万一、導入生物が拡散した場合、新たな生息場所に適応する(すなわち、自立した個体群を形成する)能力を検討する。導入が計画されている生物の適応性が高い場合、その種の導入は見合わせたほうがよいかもしれない。
検討の第3段階では、費用便益分析が行われる。導入が計画されている生物が、環境に受け入れがたいダメージをもたらし、人への有害性を示す場合、その生物は導入されるべきではない。
検討の第4段階では、学術文献やFAOの「生物種便覧(Species
Synopsis)」で使われている形式に沿ったデータベースの調査が行われる。さらに、調査では、過去に行われた、似通ったタイプの導入による環境への影響について、あらゆる情報を得るべきである。
検討の第5段階では、外来魚実験計画委員会が、たとえば残っている疑問を解決し潜在的な問題を明らかにするために、さらなる調査の実施を要請することができる。どのような調査が必要とされるか追加の調査の結果によって、第5段階の評価プロセスを繰り返さなければならない場合もある。
遺伝子組換え魚の野外試験に関する今後のリスク評価の枠組みを構成する要素
トランスジェニックの水生動植物が実験室で作りだされた場合、次に、アラバマ州でのトランスジェニックコイやナマズの試験で使われたような野外の封じ込め施設で試験を開始することになる。試験の結果から、トランスジェニック種の成長パターン、行動など多くのデータが得られると思われるが、これは閉鎖系で行われる試験なので、今後行う野外の水生環境での試験の叩き台程度に考えるべきである。それでも、試験を安全に進めることが可能になるのはたしかで、研究者は試験手順に慣れる機会を得て、規制当局は水生生物に関するリスクを評価し、その評価に基づいて試験のためのガイドラインや規則を定めることができる。しかし、こうした試験は手間と費用がかかるため、安易に実施されることはほとんどない。また、世界に数多くある研究施設のなかで、こうした試験を行うことのできる施設の数はかなり少ないことも認識すべきである。
いまのところ、開放系の水生環境での遺伝子組換え生物の試験を計画している機関はない。ここで、試験をする側と規制当局は、たとえ野外施設とはいえ閉鎖系の試験では経験しなかった特殊な問題に直面することになる。大気圏中での野外試験と同様(Stetzenbach
et al.,
1992)、開放系の水生環境で行われる試験では、被験生物の生物学的隔離が保証されない可能性がある。生物学的隔離が保証されない大きな理由は2つある。第1は海洋生物の生殖特性によるもので、これは往々にして、水生環境に放出される卵や稚魚の数が多いことと関係しており、また第2に、水空間が連続していること、水とそこに漂う粒子が絶えず動いていること、そして遺伝子分散について未知の生物学的様式が存在するかもしれないという、水生環境における3つの特徴のためである(Zilinskas
& Lundin,
1993)。さらに、外来生物の過去の導入から得られた大きな教訓として、試験中の水生種の一部が拡散した場合、それらが定着する可能性も、自然のメカニズムを通じて分散する可能性も、事前に判断することはできない、つまり、拡散による影響が予測不能だということである。こうした困難と不確実性を考えると、今後行われる水生生物の野外試験の評価プロセスは、細心の配慮をもって立案されなければならない。
こうした評価プロセスは、KohlerやStanleyの考案したものや、先に説明したものを採用することになるかもしれない。つまり、研究機関のバイオセーフティー委員会によって案件ごとに設置される試験委員会が定める指針とともに、5段階の手順にしたがうことになる。
すなわち、検討の第1段階では、科学的にみた試験の実行可能性、科学あるいは産業(またはその両方)にとって見込まれるトランスジェニック種の価値、被験対象が試験区域から拡散する可能性を含め、導入案の実行可能性を判断する。
検討の第2段階では、トランスジェニック生物が拡散した場合に、その生物が新たな生息場所に適応する能力を検討する。トランスジェニック生物の適応性が高いと考えられる場合には、まず不妊化してからでなければ野外試験を行うべきではない(以下を参照)。
検討の第3段階では、試験にかかわるリスクを評価する。このリスク評価は、試験が計画されているトランスジェニック生物が、環境に受け入れがたいダメージをもたらし、人への有害性を示す可能性がないかどうかを明らかにしようとするものである。準拠するリスク評価の枠組みとして、NRCやOECDが陸生環境での試験のために考案したものを採用することが十分可能であることは、先にも解説、検討したとおりである。
(NRCやOECDのリスク評価体系では考慮されていない要因の1つに、水生動物の繁殖能がある。先にも述べたように、水生生物が大量の卵を放出することや、流水の性質によって卵が広い区域に拡散されることから、陸上でみられるのとは違った状況が生まれる。そこで、トランスジェニックの魚介類の野外試験に関連するリスクを低減できる最良の方法は、養殖しようとする被験対象をすべて不妊化することだと考えられる。たとえば魚の場合、2つの方法によって不妊化することができる。第1は、ある種のホルモンを魚の胚に投与することによる不妊化。この方法では100%不妊化することができず、またホルモンが食用魚に残留する可能性があるため、研究者の支持を得られていない。第2は、魚の卵を処理してその後代が三倍体〔それぞれの魚が持つ染色体が2セットではなく3セット〕になるようにすること。三倍体には生殖能がない。さらなる安全のためには、三倍体の誘導は、後代がすべて雌になるような追加の処理と組み合わせて行うことができる。三倍体の雌は、100%生殖能がない。しかし、生殖能のない系統は、試験区域とは別の安全な封じ込め施設で維持する必要がある〔Kapuscinski,
1990〕)。
検討の第4段階では、似通ったタイプの過去の導入による環境への影響についてあらゆる情報を得るために、学術文献やFAOの「生物種便覧」で使われている形式に沿ったデータベースの調査が行われる。トランスジェニック生物そのものに関しては得られる情報はわずかだったりなかったりする場合でも、遺伝子(およびそのオペロン)が1つ追加されたり変更されているだけなので、このトランスジェニック生物が遺伝的にはその野生近縁種と同じであることを思い出すべきである。つまり、試験区域へのトランスジェニックコイの導入などによる影響は、過去にその野生近縁種を新たな区域に導入した際の影響と同じである可能性がきわめて高いはずである。
検討の第5段階では、たとえば区域の性質や被験対象の繁殖能を明らかにするために、試験委員会が追加の調査の実施を要請することになると思われる。試験区域を含む生態地域を明確にし、その生態地域のなかの小区域を明らかにし、比較のために用いる基準区域を示すなどのために、さらなるデータが必要になることが想定される。この調査の結果によっては、第5段階の評価プロセスが繰り返される場合もある。
図8.1 外来種導入案の評価のための検討・決定モデル

水産バイオテクノロジー、あるいはより具体的に遺伝子工学によって得られた無生物の産物や水生生物は、リスク評価担当者や規制当局にとって特別な、あるいは固有の問題を生じさせるだろうか。これまでの節で示した解説や議論、分析から、答えはノーでもありイエスでもあると思われる。
自然の無生物産物は、陸生生物に由来するものか水生生物に由来するものかを問わず、同じ方法で性質が明らかになる。たとえば、カルバミン酸塩、ラクトン、テルペンは、その構造は大幅に異なるが、これらが単離された元が海綿動物か陸生植物かに関係なく、ある共通の一般的な性質を持つ。極限環境から採集され、スクリーニング、研究される生物が増えるにつれて、抗菌、抗ウイルス、抗腫瘍などの性質を示す、優れた化合物が見つかるのは確実である。しかし、一般のバイオテクノロジーでの経験に照らした場合、ある水生の自然産物の構造がどんなに特殊でも、新たなリスク評価枠組みや規制制度を必要とするような新規な状況や著しい有害性を生みだすことはない。たとえば、ある特殊な海洋毒素が発見された場合、その生理作用が既知の毒素のものと顕著に異なる可能性は低く、その毒性が既知の毒素のものより大幅に強い可能性も低い。したがって、定められた手続きにしたがって試験を行えば、その新たな化合物の化学構造は解明され、作用機序が説明され、最終的にはその有効性と安全性が評価されることになる。
自然の無生物産物と同様、遺伝子改変微生物に使われたり、水産バイオテクノロジーの手法によって開発される細胞培養系は、特別な管理措置や規制を必要とするような例外的な状況を生みだすことはない。たとえば、ウイルス性の魚の病害に対する組換えワクチンの開発は、他の動物用ワクチンを開発するのに使われるのと同様の手法が使われるはずであり、魚用ワクチンの野外試験は、確立されている動物用ワクチンの試験手順にしたがって行われるはずで、開発・試験プロセス全体は、現行の国の規制当局によって適切に監視されることになる。したがって、伝統的あるいは先端バイオテクノロジーによって得られた製品を試験するための現行の手順を、水産バイオテクノロジー製品の試験に用いることは妥当である。このため、水生環境で利用される無生物のバイオテクノロジー産物が、リスク評価担当者や規制当局にとって特別な、あるいは固有の問題を生じさせることはない。
もし誰かが、池や湖、川あるいは河口の汽水域に設置したケージや囲いの中でトランスジェニック魚を集めて養殖し、その優れた性質から利益を得ようとすれば、トランスジェニック魚の一部が拡散する可能性は高まると考えられる。そうした拡散による影響は予測できないが、既存の野生生物に及ぼすダメージは、目には見えないごくわずかなものから、深刻なものにわたる可能性がある。過去に陸上で行った生物の野外試験での経験からすると、被験対象のゲノムに挿入する異種遺伝子を1つにして、遺伝的改変が最小限に抑えられている限りは、悪影響が生じる可能性は低い。
現在、予想される水生トランスジェニック生物の野外試験の状況は、10年前に陸生植物の野外試験が行われようとしていた時の状況と似ている。しかし、考え方によっては、こうした最初の頃とは違い、科学者たちは過去の野外試験の経験を利用し、今後行われる水生環境での野外試験に役立つ教訓を得ることができる。さらに、より優れたリスク評価の手法も開発されており、遺伝物質の検出や追跡のための高度な技術も利用できる。つまり、現在の科学者は、以前に比べていくつかの点で状況が整っているのである。第1に、陸生環境で価値の立証されたリスク評価法を採用することができる。取りうる方法については、本章の前の部分で示した。第2に、試験に先立って、新たに改正されたリスク評価法を使って環境影響に関する包括的な説明書を作成することができる。第3に、こうしたリスク評価枠組みは、安全な試験手順を立案し、試験やその長期の影響をモニタリングするのに効果的な仕組みを設けるのに適していることがわかるはずである。
水生トランスジェニック生物の野外試験の実施を検討する上で、現在の科学者たちは状況が整っていると述べたが、トランスジェニックの水生動植物や微生物の野外試験によって生じうる影響を評価し、決定することは依然としてきわめて難しい。さらに、現在のリスク評価枠組みは、水生環境への言及が不充分だったり、不適切だったりすることは、前述したとおりである。外来の水生動植物の意図的あるいは偶発的な導入にかかわるリスク評価に使われている枠組みは、長い実績はあるものの、いまだに発展中で未完成である。こうした短所を考慮すると、現行の規制や法律は、トランスジェニック水生動植物の野外試験を管理するには適していないということができる。結論として、現在の規制状況は、トランスジェニックの水生生物を開放系環境で試験するのには不利であると言わざるを得ない。こうした野外試験は多くの不確定要素を伴うため、生物海洋学や微生物生態学、環境毒性学の研究によって生物や遺伝子の水生環境への拡散の仕組みが明らかになり、水生トランスジェニック生物の野外試験のための充分なリスク評価法が開発されるまでは、規制当局はそうした決定を見送るべきである。
注
1. 本章で使われている拡散に関する用語は、国際海洋探査委員会(ICES)によって考案された定義にしたがっている(Mann & Rosenfield, 1992)。したがって、導入種とは、現在の分布域“以外の”環境に意図的あるいは偶発的に運ばれて放出された種をいう。移動種とは、現在の分布域の“内部に”意図的あるいは偶発的に運ばれて放出された種をいう。種は、自然の作用を通じて、あるいは人間の活動の過程で導入されたり移動したりする可能性がある。
参考文献
Andrews, C. (1992) The ornamental fish trade and fish conservation. INFOFISH Int., No. 2, 25-29.
Anonymous (1990) Transgenic fish experiment gets green light. Biotechnol. Notes, 3(10), 1-2.
Anonymous (1991) Transgenic catfish may be next in line. Biotechnol. Notes, 4(10), 2-3.
Anonymous (1992) ABRAC panel gives nod to catfish study. Biotechnol. Notes, 5(4), 1.
Aquatic Nuisance Species Task Force (1992) Proposed Aquatic Nuisance Species Program. United States National Fish and Wild Life Service, Alexandria, VA, USA.
Authur, R. & Sheriff, M. (1991) Towards international fish disease control in Southeast Asia. INFOFISH Int. No. 3, 45-48.
Baskin, Y. (1992) Africa’s troubled waters. BioScience, 42(7), 476-481.
Brown, L.M., Dunahay, T.G. & Jarvis, E.E. (1989) Applications of genetics to microalgae productions. In: Developments in Industrial Biotechnology, Volume 31, Pierce, G.E. (ed.), pp. 271-274. Elsevier, New York.
Carlton, J.T. (1989) Man’s role in changing the face of the ocean: Biological invasion and implications for conservation of near-shore environments. Conserv. Biol., 3(3), 265-273.
Carlton, J.T. (1992a) Marine species introductions by ship’s ballast water: An overview. In: Introductions and Transfers of Marine Species: Achieving a Balance Between Economic Development and Resource Protection, DeVoe, M.R. (ed.), pp. 23-26. South Carolina Sea Grant Consortium, Milton Head Island, SC, USA.
Carlton, J.T. (1992b) Dispersal of living organisms into aquatic ecosystems as mediated by aquaculture and fisheries activities. In: Dispersal of Living Organisms Into Aquatic Ecosystems, Rosenfield, A. & Mann, R. (eds.), pp. 13-48. Maryland Sea Grant College, College Park, MD, USA.
Carlton, J.T. (1992c) An international perspective on species introductions: the ICES protocol. In: Introductions and Transfers of Marine Species: Achieving a Balance Between Development and Resource Protection, DeVoe, M.R. (ed.), pp. 31-34. South Carolina Sea Grant Consortium, Hilton Head Island, SC, USA.
Chen, T.T. & Powers, D.A. (1990) Transgenic fish. Trends Biotechnol., 8(8), 209-215.
Chen, T.T., Lint C,M., Gonzalez-Villasenõr, L.1., Dunham, R., Powers, D.A. & Zhu, Z. (1992) Fish genetic engineering: A novel approach in aquaculture. In: Dispersal of Living Organisms Into Aquatic Ecosystems, Rosenfield, A. & Mann, R. (eds.), pp. 265-280. Maryland Sea Grant College, College Park, MD, USA.
Colwell, R.R. (1986) Marine Biotechnology and the Devloping Countries. UNIDO report IS. 593, January 7. United Nations Industrial Development Organization, Vienna.
Colwell, R.R. (1987) Genetically engineered organisms in the ocean environment – risks and benefits. In: Microbes in the Sea, Sleigh, M.A. (ed.), pp. 182-189. John Wiley & Sons, New York.
Contreras-B., S. & Escalante-C., M.A. (1984) Distribution and Known Impacts of Exotic Fishes in Mexico. In: Distribution, Biology, and Management of Exotic Fishes, Courtenay Jr, W.R. & Stauffer Jr, J.A. (eds.), pp.102-130. The Johns Hopkins Press, Baltimore, MD, USA.
Costerton, W. & Lappin-Scott, H.M. (1989) Behaviour of bacteria in biofilms. ASM News, 55, 650-654.
Courtenay Jr, W.R. & Williams, J.D. (1992) Dispersal of exotic species from aquaculture sources, with emphasis on freshwater fishes. In: Dispersal of Living Organisms Into Aquatic Ecosystems, Rosenfield, A. & Mann, R. (eds.), pp. 49-82. Maryland Sea Grant College, College Park, MD, USA.
Crossman, E.J. (1984) Introduction of exotic fishes into Canada. In: Distribution, Biology and Management of Exotic Fishes, Courtenay Jr, W.R. & Stauffer Jr, J.A. (eds.), pp. 78-101. The Johns Hopkins Press, Baltimore, MD, USA.
Davidson, J.R., Brook, J.A. & Young, L.G.L. (1992) Introduction of exotic species for aquaculture purposes. In: Dispersal of Living Organisms into Aquatic Ecosystems, Rosenfield, A. & Mann, R. (eds.), pp. 83-102. Maryland Sea Grant College, College Park, MD, USA.
Devlin, R.H. & Donaldson, E.M. (1992) Containment of genetically altered fish with emphasis on salmonids. In: Transgenic Fish, Hew, C.L. & Fletcher, G.L. (eds.), pp. 229-265. World Scientific, NJ, USA.
Donaldson, E.M. & Devlin, R.H. (1993) Aquaculture biotechnology in Canada including the development of transgenic salmon. In: The Proceedings of the Symposium on Aquatic Biotechnology and Food Safety, pp. 47-56. Organisation for Economic Cooperation and Development, Paris.
Engleking, H.M. & Leong, J.C. (1991) Sub-unit vaccine trials using glycoprotein and nucleoprotein constructs of the rhabodovirus, Infectious Haematopoietic Necrosis virus. In: Proc. 14th Ann. AFS/FHS Meeting; 32nd Western Fish Disease Conference. July 31 – August 3, Newport. p. 45. Oregon State University/Hatfield Marine Science Centre, USA.
Erdman, D.S. (1984) Exotic fishes in Puerto Rico. In: Distribution, Biology, and Management of Exotic Fishes, Courtenay Jr, W.A. & Stauffer Jr, J.A. (eds.), pp. 162-176. The Johns Hopkins Press, Baltimore, MD, USA.
Farley, C.A. (1992) Mass mortalities and infectious lethal diseases in bivalve Mollusca and associations with geographic transfers of populations. In: Dispersal of Living Organisms Into Aquatic Ecosystems, Rosenfield, A. & Mann, A. (eds.), pp. 139-154. Maryland Sea Grant College, College Park, MD, USA.
Ganzhorn, J., Rohovec, J.S. & Fryer, J.L. (1992) Dissemination of microbial pathogens through introductions and transfers of fish. In: Dispersal of Living Organisms Into Aquatic Ecosystems, Rosenfield, A. & Mann, R. (eds.), pp. 175-194. Maryland Sea Grant College, College Park, MD, USA.
Hallerman, E.M. & Kapuscinski, A.R. (1992) Ecological and regulatory uncertainties associated with transgenic fish. In: Transgenic Fish, Hew, C.L. & Fletcher, G.L. (eds.), pp. 209-228. World Scientific, New Jersey, USA.
Harvey, S., Elashvili, I., Valdes, J.J., Karnely, D. & Chakrabarty, A.M. (1990) Enhanced removal of Exxon Valdez spilled oil from Alaskan gravel by a microbial surfactant. Bio/Technology, 8, 228-230.
Hoffman, J. (1990) Provesta forms marine biology company. Chem. Mark. Report., 238(22), 27.
Holloway, M. (1991) Soiled shores. Sci. Am., 265, 102-116.
Jacob, M.T. (1994) Marine aquaculture growth faces regulatory and environmental obstacles. Genet. Engineering News, 14(1), 32-34.
Kapuscinski, A.R. (1990) Integration of transgenic fish into aquaculture. Food Rev. Int., 6(3), 373-388.
Kern, F.G. & Rosenfield, A. (1992) Shellfish health and protection. In: Dispersal of Living Organisms Into Aquatic Ecosystems, Rosenfield, A. & Mann, A. (eds.), pp. 313-324. Maryland Sea Grant College, College Park, MD, USA.
Kohler, C.C. & Stanley, J.G. (1984) A suggested protocol for evaluating proposed exotic fish introductions in the United States of America. In: Distribution, Biology, and Management of Exotic Fishes, Courtenay Jr, W.A. & Stauffer Jr, J.R, (eds.), pp. 387-406. The Johns Hopkins Press, Baltimore, MD, USA.
Lightner, D.V., Redman, R.M., Bell, T.A. & Thurman, R.B. (1992) Geographic dispersion of the viruses IHHN, MBV and HPV as a consequence of transfers and introductions of Penaeid shrimp to new regions for aquaculture purposes. In: Dispersal of Living Organisms into Aquatic Ecosystems, Rosenfield, A. & Mann, A. (eds.), pp. 155-174. Maryland Sea Grant College, College Park, MD, USA.
Maciolek, J.A. (1984) Exotic fishes in Hawaii and other islands of Oceania. In: Distribution, Biology, and Management of Exotic Fishes, Courtenay Jr, W.R. & Stauffer Jr, J.R. (eds.), pp. 131-161. The Johns Hopkins Press, Baltimore, MD, USA.
Mann, D.W. (1990) Seaweeds and biotechnology – inseparable companions. Hydrobiologia, 204/205, 7-13.
Mann, R. & Rosenfield, A. (eds.) (1992) Dispersal of Living Organisms into Aquatic Ecosystems, Maryland Sea Grant College, College Park, MD, USA.
McDowall, R.M. (1984) Exotic fishes: The New Zealand experience. In: Distribution, Biology and Management of Exotic Fishes, Courtenay Jr, W.A. & Stauffer Jr, J.R. (eds.), pp. 200-214. The Johns Hopkins Press, Baltimore, MD, USA.
McKay, R.J. (1984) Introduction of exotic fishes in Australia. In: Distribution, Biology, and Management of Exotic Fishes, Courtenay Jr, W.R. & Stauffer Jr, J.R. (eds.), pp. 177-199. The Johns Hopkins Press, Baltimore, MD, USA.
Meyer, F.P. (1991) Aquaculture disease and health management. J. Anim. Sci., 69, 4201-4208.
Miller, H.I., Burris, R.H. & Vidaver, A.K. (1991) Regulation of biotechnology (letter). Science, 252, 1599-1600.
Morse, A.N.C. (1991) How do planktonic larvac know where to settle? Am. Sci., 79, 154-167.
Neushul, M., Amsler, C.D., Reed, D.C. & Lewis, R.J. (1992) Introduction of marine plants for aquaculture purposes. In: Dispersal of Living Organisms into Aquatic Ecosystems, Rosenfield, A. & Mann, R. (eds.), pp. 103-138. Maryland Sea Grant College, College Park, MD, USA.
NRC (1989) Field Testing Genetically Modified Organisms: Framework for Decisions. National Academy Press, Washington, DC.
OECD (1986) Recombinant DNA Safety Considerations. Directorate for Science, Technology and Industry, Organisation for Economic Co-operation and Development, Paris.
OECD (1992) Safety Considerations for Biotechnology-1992. Directorate for Science, Technology and Industry, Organisation for Economic Co-operation and Development, Paris.
OTA (1991) Bioremediation for Marine Oil Spills. United States Congress, Office of Technology Assessment, Washington, DC.
Peterson, M.N.A. (ed.) (1992) Diversity of Ocean Life: An Evaluative Review, Centre for Strategic and International Studies, Washington, DC.
Powers, D.A. (1990) Marine and freshwater biotechnology: a new frontier. In: Biotechnology: Perspectives, Policies and Issues, Vasil, I. (ed.), pp. 41-70. University of Florida Press, Gainesville, FL, USA.
Powers, D.A., Chen, T.T. & Dunham, R.A. (1991) Gene-spliced fish experiments, Science, 254, 779.
Renn, D.W. (1986) Marine algae biotechnology: Possibilities and realities. In: Workshop on Marine Algae Biotechnology: Summary Record, Board on Science and Technology for International Development (ed.), pp. 53-67. National Academy Press, Washington, DC.
Robinson, P.K. (1985) Phycotechnology. Ind. Biotechnol., 42(5), 73-78.
Shears, M.A., Fletcher, G.L., Hew, C.L., Gauthier, S. & Davies, P.L. (1991) Transfer, expression and stable inheritance of antifreeze protein genes in Atlantic salmon (Salmosalar). Mol. Mar. Biol. Biotechnol., 1(1), 58-63.
Sindermann, C.J. (1986) Strategies for reducing risks from introduction of aquatic organisms: A marine perspective. Fisheries, 11(2), 10-15.
Sindermann, C.J. (1992) Role of the International Council for the Exploration of the Sea (ICES) concerning introductions of marine organisms. In: Dispersal of Living Organisms into Aquatic Ecosystems, Rosenfield, A. & Mann, R. (eds.), pp. 367-376. Maryland Sea Grant College, College Park, MD, USA.
Stetzenbach, L.D., Hern, S.C. & Seidler, R.J. (1992) Field sampling design and experimental methods for the detection of airborne microorganisms. In: Microbial Ecology: Principles, Methods and Applications, Levin, M.A., Seidler, R.J. & Rogul, M. (eds.), pp. 543-555. McGraw-Hill Inc., New York.
Stickney, R.R. (1992) The importance of introduced marine species to the development of the marine aquaculture industry in the United States of America and Puerto Rico. In: Introductions and Transfers of Marine Species: Achieving a Balance Between Economic Development and Resource Protection, DeVoe, M.R. (ed.), pp. 17-22. South Carolina Sea Grant Consortium, Milton Head Island, SC, USA.
Strausberg, R.L. & Link, R.P. (1990) Protein-based medical adhesives. Trends Biotechnol., 8(2), 53-57.
Teso, B. (1992) International harmonization of safety principles for biotechnology. In: Proceedings of the 2nd International Symposium on the Biosafety Results of Field Tests of Genetically Modified Plants and Microorganisms, May 11 – 14, 1992, Goslar, Germany. Casper, R. & Landsmann, J, (eds.), pp. 7-15. Biologische Bundesanstalt fur Landund Forstwirtschaft, Braunschweig, Germany.
Thorgaard, G.H. & Allen, S.K. (1992) Environmental impacts of inbred, hybrid and polyploid aquatic species. In: Dispersal of Living Organisms Into Aquatic Ecosystems, Resenfield, A. & Mann, A. (eds.), pp. 281-290. Maryland Sea Grant College, College Park, MD, USA.
UNIDO (1992) Voluntary code of conduct: Release of organisms into the environment. Biotechnol. Eur., 9(4), 218-221.
USDA (1990) Environmental Assessment of Research on Transgenic Carp in Confined Outdoor Ponds. Office of Agricultural Biotechnology, Office of the Secretary, United States Department of Agriculture, Washington, DC.
Weiner, J. (1985) Marine biotech in the Negev desert. Bio/Technology, 3-39.
Welcomme, R.L.I. (1986) International measures for the control of introductions of aquatic organisms. Fisheries, 11(2), 4-9.
Zilinskas, R.A. & Lundin, C.G. (1993) Marine Biotechnology for the Developing for the Countries. World Bank, Washington, DC.
Zilinskas, R.A., & Colwell, R.R., Lipton, D.W. & Hill, R.T. (1995) The Global Challenge of Marine Biotechnology: A Status Report of Marine Biotechnology in the United States of America, Japan & Other Countries. Maryland Sea Grant College, College Park, MD, USA.