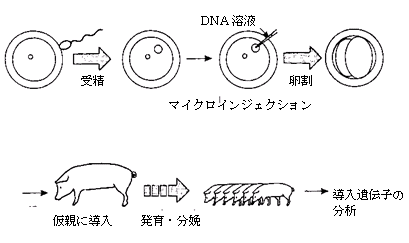
(a)DNAを胚に導入するもっとも一般的な方法は、マイクロインジェクション(顕微注入)である。受精後すぐに、微小ガラス管を大きい方の雄性前核に挿入し、10-12mlを注入する。DNAを注入された胚は仮親に移し、産み月まで育てる。この操作を行った胚の8つにつき1つが生き残り、そのうち、5分の1が導入された遺伝子のコピーが含まれる。
ドン・パウエル
バブラハム研究所・発生シグナル部・細胞決定研究室(英国・ケンブリッジ州・バブラハム)
はじめに
ある意味でいえば、さまざまな種類の家畜を育種することなど遺伝子操作には数千年の歴史がある。普通のオオカミ種をもとにペキニーズからグレートデーンに至る多種多様な犬種を得るのにかかった時間は、ほんの二、三百年である。こうした育種の取り組みでは、「科学的に」考案されたかどうかは別にして、「望ましい」形質を示す動物は繁殖が続けられ、「望ましくない」形質の動物ははずされる。伝統的育種法による実験は、すべてこの種の遺伝的改良を基礎としており、染色体の組換えとその染色体が偶然に組み合わさって望ましい形質になることに頼っており、時間と費用のかかる仕事である。動物育種学における最新技術は劇的に様変わりしている。つまり、核移植法、クローニング法、雌雄鑑別法、トランスジェニック生物学は、動物の表現型に劇的な変化を生じさせることができる。こうした変化によって、新たな恩恵がもたらされるかもしれないが、それによってどのような問題が生じるだろうか。本章では、トランスジェニック(遺伝子導入)動物と組換えタンパク質の性質を、これらの技術が環境に及ぼす影響という枠組みのなかで検討する。そこでは、現行の規制、とりわけ米国と英国の規制についても概観するが、両者は同じ問題に対して異なる対応を取っている。注目に値するのは、米国農務省(USDA)がこれまでに300件以上のトランスジェニック植物の放出を承認している一方で、トランスジェニック動物(コイ)の封じ込め放出で完全に実施されたものはわずか1件だという点である。このことは、動物に導入される形質がきわめて複雑であるために、科学界で数々の疑問が提起され、しばしば国民の懸念の種になっているという事実によって説明できる。
定義範囲
以下の検討項目は自明のものとして議論を進める。遺伝子組換え生物(GMO)やトランスジェニック動物、あるいは組換えタンパク質の定義は何だろうか。トランスジェニック動物の概念は単純で、一言でいえば、そのゲノムに、両親のどちらにもないDNA配列(導入遺伝子)を持つ動物のことである。各種の研究実験では、このDNAが、成長ホルモンやα1-抗トリプシンなどの機能性タンパク質の合成を指令する場合、β-ガラクトシダーゼなどのマーカータンパク質の合成を指令する場合、単にゲノム中のDNAマーカーの1つとして単独で機能する場合がある。このいずれもが遺伝子導入の例だが、動物の生理機能の改変が意図されているのは最初の例だけである。本章で取り上げるのは、この分野である。トランスジェニック動物を作出する経路はいくつかあり(後述の「組換えゲノムの生成」を参照)、そのそれぞれが生物にさまざまな性質を与える。
組換えタンパク質は、in
vitroで操作されたDNA(rDNA)に由来し、「自然の」遺伝子配列を組み合わせたり、遺伝子配列を切り取ったり、あるいは合成したDNA配列を加えたりして作られる。狭義の組換えタンパク質は、自然界に存在するものとは異なる配列を含むものをいう。広義かつ通常用いられている意味での組換えタンパク質は、大腸菌(Escherichia
coli)、酵母、動物培養細胞あるいはトランスジェニック動物を問わず、外来遺伝子(導入遺伝子)から合成されたタンパク質をいう。次の節では、この定義が安全性を懸念する人々にとって災いしていることについて論じる。
組換えの遺伝子やタンパク質は特別か
組換え遺伝子やゲノムが特別なのは、その生成方法のためである。それらの基盤となる技術には、ほんの15年ほどの歴史しかない。だから安全性に問題がある、といえるだろうか。製品の安全性というのは、それが生物学的製品か化学的製品か物理学的製品かにかかわらず、その挙動、つまり性質によって決まるものであって、製造法によって決まるものではない(Miller,
1991)。自動車の安全性は、その安全性試験での挙動によって規定されるもので、それが手作りされたか生産ラインで作られたかによって規定されるものではない。その意味からすると、GMOは、その生成方法を理由に特別な区分を形成するものではなく、また、この生成方法に付随する特別なリスクの区分がないことについても広く受け入れられている。もし、組換え産物(遺伝子やタンパク質)の挙動あるいは性質が自然の産物と異なるなら、重要なのは、その新たな挙動の意味合いを評価することである。
たとえば、導入遺伝子は内在の遺伝子と比較して安定性が低いかもしれない。これは、評価の対象にしなければならない性質の1例である。しかし、環境中での挙動を左右するのは、その新規の遺伝子型が持つ生物学的な性質である。このことは、新規の「自然の」ゲノムにも、組換えゲノムと同じくらいあてはまることである。オーストラリアでの、まったく新規であると同時にまったく「自然の」ゲノムを持つウサギの放出は、生態系に広範な影響を及ぼし、トランスジェニック動物のきわめて慎重に計画された放出ではまず考えられない規模での損害を引き起こしている。
同様に、組換えタンパク質も、その生成方法からして、必ずしも特別なリスク区分を示すものではない。自然界にはみられない性質を持つタンパク質を作るために遺伝子操作が用いられる場合、そのタンパク質に伴う有害性を判断するには、主として新たな食品、医薬品、工業製品の評価に用いられるのと同じガイドラインに従うことになる。つまり、組換えゲノムの環境への影響は、自然ではあるが外来のゲノムによる影響と本質的には変わらないのである。
組換えゲノムの生成
トランスジェニック動物
トランスジェニック動物の作出の歴史は、10年余りである(Brinster et al., 1981)。この間に、動物にDNAを組み込むための方法がいくつか開発された(図7.1、表7.1)。
マイクロインジェクション(微量注入)法―DNAを受精卵の前核(通常は大きい方の雄性前核)に注入するもので、トランスジェニックマウスの大多数の系統や家畜種のトランスジェニック系統のほぼすべてが、この方法によって生み出されている。マイクロインジェクション法は、トランスジェニックの魚類や家禽類の作出にも用いられている(Chen & Powers, 1990; Love et al., 1994)。こうしたケースでは、核が不鮮明であるか、まったく検出できないために、DNAは細胞質内に導入されることが多い。この方法はおおむね信頼できるが、組み込まれる部位がランダムで、組み込まれるDNAのコピー数を予測することができず(ただし、低濃度のDNAを使って、ゼロから2ないし3コピーの範囲を目指すことはできる)、一定の割合の動物がモザイク(すべての細胞に導入遺伝子が含まれない)になる。しかし、コピーを1つだけ含む個体を選択すること、発現が適切なレベルかを判断すること、また同型接合の導入遺伝子が宿主ゲノム中で安定であることを立証することは、トランスジェニック系統を確立することを意図した育種計画によって可能になる。こうした要素がいったん決定されれば、その導入遺伝子は、宿主に内在する「正常な」遺伝子としてふるまうことになる。
胚性幹細胞(ES細胞)―胚性幹細胞(ES細胞)とは、初期胚由来の細胞で、培養中で成長させてから受容体の胚に戻すことができ、そこから分化した細胞が、発生する生物の全組織のもとになる(Evans & Kaufman, 1981)。培養期間中に外来DNAを簡単な方法で細胞に導入することができ、導入遺伝子の発現や安定性を検証することが可能である。ES細胞の大きな利点は、宿主ゲノムにきわめて微細な改変をも導入することができる点である(Thomas & Capecchi, 1990)。コンストラクトは、宿主遺伝子と相同でありながら、その遺伝子配列が途切れており、改変された部分を含むように構築することができる。まれに、in vitroでのDNAのトランスフェクションによって、導入遺伝子と内在遺伝子の相同性に基づく内在遺伝子への導入が起こることがある。この方法では、それらの遺伝子配列を、1塩基対の変更から、タンパク質コード領域の大部分を欠失させることまで、どんな微妙なレベルでも変えることができる(Bradley, 1993)。現時点では、この高度な手法は哺乳類種、主に齧歯類だけに適用されている。このきわめて貴重な技術を農業上の重要種に利用するため、在来種から信頼性の高いES細胞培養系を得ることに世界中で多くの努力と多額の費用がつぎ込まれている(Notarianni et al., 1990)。
図7.1 トランスジェニック動物作出の4つの主な方法
(a) マイクロインジェクション法

(a)DNAを胚に導入するもっとも一般的な方法は、マイクロインジェクション(顕微注入)である。受精後すぐに、微小ガラス管を大きい方の雄性前核に挿入し、10-12mlを注入する。DNAを注入された胚は仮親に移し、産み月まで育てる。この操作を行った胚の8つにつき1つが生き残り、そのうち、5分の1が導入された遺伝子のコピーが含まれる。
(b)ES細胞
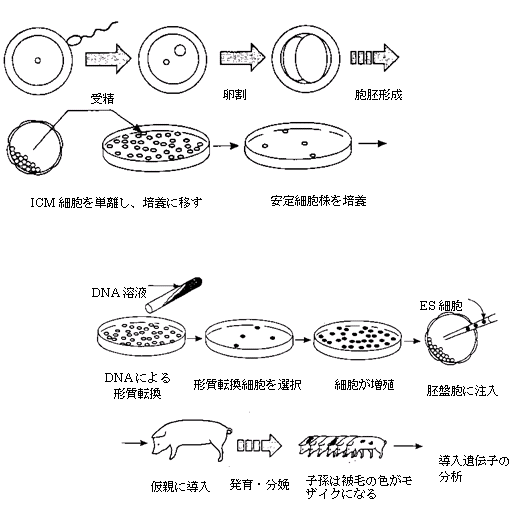
(b)ごく最近の手法では、シャーレの中で胚盤胞の内部細胞に由来する初期胚細胞を培養樹立する。DNAは、in
vitroでこの胚性幹細胞(ES細胞)上に導入すればよく、導入遺伝子を含み適切に形質転換した細胞を選択し、分離して増殖させる。選択した細胞のいくつかを、分化して最終的に生まれる動物のあらゆる組織になる能力を持つ胚盤胞に注入する。供与側と受容側の胚盤胞が由来する動物の被毛の色が異なっている場合、トランスジェニック細胞を含むモザイク個体は、供与細胞の被毛の色が一部に現れることによって同定することができる。この操作の成功率は高く、通常、マウスの2匹に1匹には一定のトランスジェニック細胞が含まれる。
(c)レトロウイルスベクター
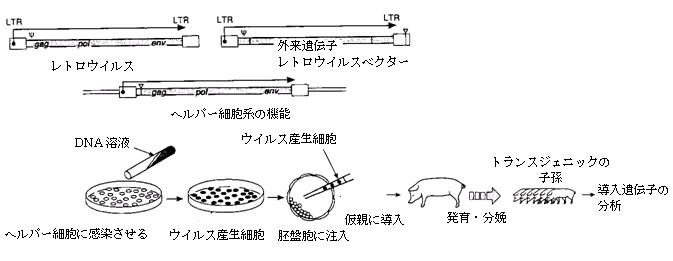
(c)無力化したウイルスベクターを用いる方法もある。ウイルスDNAを宿主染色体に導入するのに必要な配列(Ψ配列という)だけを含むベクターが、遺伝子工学によって作りだされている。これら欠損ウイルスベクターは、約7,000塩基対の外来DNAを運ぶことができる。ヘルパー細胞はウイルスの機能を持つが、Ψ配列は含んでいない。この培養細胞を用いて、外来DNA(ウイルスベクター)をウイルス粒子にパッケージングし、これらの欠損ウイルス粒子を初期胚の細胞に注入すると、導入遺伝子を宿主染色体に高い効率で組み込むことができる。
レトロウイルスベクターは、1980年代初期に開発されて以来、大きな期待を持たれている(Miller et al., 1983)。レトロウイルスは、複製の過程で自身のDNAコピーを作るRNAウイルスで、このDNAコピーが宿主細胞のゲノムに組み込まれる。組換えDNAの手法を用いることによって、ウイルスタンパク質をコードする遺伝子を、宿主ゲノムへのDNAの組み込みに必要な配列だけを残して取り除くことができる。こうすることによって、外来DNAがウイルス配列に組み込まれ、削除されたウイルスの機能を提供する「ヘルパー」細胞系を使って受容体の細胞に移行させることができる。発現の安定性の問題やウイルスベクターの安全性への懸念から、こうした実験は動物バイオテクノロジーの分野に限って行われてきた。しかし、レトロウイルスベクターは、トランスジェニックの家禽類の作出に使われた(Salter & Crittendon, 1989; Chen et al., 1990)(このときはじめてレトロウイルスが見出された)。また、ヒトへの遺伝子治療の手法としては現在のところ唯一の方法でもあるため(Anderson, 1992; Fox, 1993)、家畜種への利用が再び盛んになる可能性もある。
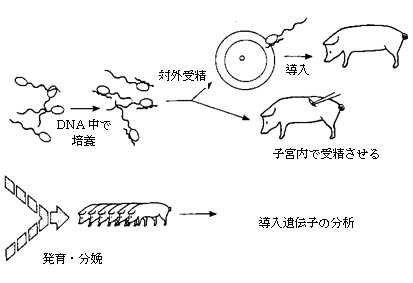
精子ベクターによるDNA形質転換―精子ベクターによるDNA形質転換は、もっとも広く適用できる可能性を持つ一方で、これまでの実績ではきわめて信頼性に欠ける技術である(Brinster et al., 1989; Gandolfi et al., 1989; Lavitrano et al, 1989)。これは非常に単純な手法なので(基本的には、DNAに精子を混ぜ、in vitroで受精させる)、世界中の実験室で行うことが可能である。しかし、信頼性が低いことと、導入遺伝子の安定性が疑問視されることが相まって、この技術は研究段階にとどまっている。
エレクトロポレーション法などの他の手法も試みられており、「伝統的な」手法では実現できなかった一部の分野で利用法が見出されている(Xie et al., 1993)。
組換えタンパク質
医学や獣医学の分野では、多くの治療用タンパク質が使われている。これらの大部分は、動物やヒトの組織に由来するものである。ブタやヒトの下垂体から抽出したごく低濃度の成長ホルモンなどを精製することが可能になっており、また、ヒトの血液の第IX因子も許容できるレベルにまで精製されている。最近の懸念は、こうしたヒトや動物の組織が遅発性ウイルスやレトロウイルスに汚染される可能性に集中している。折りよく、こうした懸念は組換えDNA技術の発展と同時期に生じてきており、さまざまな合成法が利用できるようになった(Goeddel, 1990)。現在使用されている主な方法と開発中の技術のいくつかを表7.2に挙げる。
表7.1 動物種における遺伝子導入の手段
|
方法 |
概要 |
長所 |
短所 |
参考文献 |
|
1. マイクロインジェクション |
DNAを前核(哺乳類)または核領域(魚類、鳥類)に微量注入する。 |
確立された手法である。 |
機器が複雑で高価。 |
Brinster et al., 1981; |
|
2. ES【脚注a】細胞 |
in vitroで樹立したDNAコンストラクトを胚細胞にトランスフェクトし、選別後、胚に導入する。 |
確立された手法である(齧歯類において。家畜ではまだ実験段階) |
非常に複雑 |
Evans & Kaufman, 1981; Notarianni et al., 1990; Thomas & Capecchi, 1990; Bradley, 1993 |
|
3. ウイルスベクター |
ヘルパー細胞株を用いて、改変したベクターをウイルスにパッケージングする。できた欠損ウイルス粒子を宿主の胚細胞に感染させる。 |
確立された手法である。 |
発現が不安定になることがある。 |
Huszar et al., 1985; Yu et al., 1986; Slter & Crittendon, 1989; Chen et al., 1990 |
|
4. 精子ベクターによる導入 |
DNAを付着させる精子と混ぜる。DNAは、in vitroでの受精(IVF)中に卵に移行させる。 |
きわめて簡便で、特殊な機器や培養を必要としない。 |
検証されていない。 |
Brinster et al., 1989; Gandolfi et al., 1989; Lacitrano et al., 1989 |
|
5. エレクトロポレーション |
DNA溶液中の細胞が瞬間的な高圧の電気パルスによって送り込まれる間に、DNAが細胞中に入り込む。 |
各種の細胞に利用できる可能性がある。 |
未発表の成功報告がいくつかあるものの、ほとんどの動物細胞では検証されていない。 |
Chen & Powers, 1990; Xie et al., 1993 |
【脚注a】ES細胞:胚性幹細胞。詳しい説明は用語集を参照のこと。
表7.2 組換えタンパク質の生成
|
宿主生物 |
長所 |
短所 |
例 |
参考文献 |
|
大腸菌 |
性質がよく知られており、操作が容易 |
通常、タンパク質は細胞中に残る |
インスリン |
Goeddle et al., 1979a, b; Strueli et al., 1982 |
|
酵母 |
使用の歴史が長い |
タンパク質の改質が正確でない場合がある |
肝炎抗原 |
Valenzuela et al., 1982 |
|
培養細胞 |
改変タンパク質の移行 |
培養細胞の汚染のリスクがある |
エリスロポエチン |
Kaufman et al., 1985; Goto et al., 1988 |
|
動物 |
「繁殖」が簡単(自己繁殖する) |
操作が困難 |
α1-抗トリプシン |
Archibald et al., 1990; Ebert et al., 1991; Wright et al., 1991; Swanson et al., 1992; Carver et al., 1993 |
大腸菌―大腸菌(Escherichia coli)は、組換えタンパク質を効率的に生産するために15年以上前に使われ(ジェネンテック社がヒトインスリンを合成したのは1978年)、現在でも一般的な手法として用いられている。各種の発現ベクターがあり、簡便な精製法が多く開発されてきた。グルタチオンS-トランスフェラーゼ(GST)融合ベクターはその一例で、GST部分が還元型グルタチオンを含むカラムに吸着するため、融合タンパク質は容易に単離できる。こうしたベクターには、GSTと異種タンパク質との間にプロテアーゼ認識部位(通常、トロンビンまたは第Xa因子)が含まれている。GST部分は、タンパク分解による切断によって、精製した融合タンパク質から取り除くことができる。
この方法のもっとも一般的な問題は、産物の溶解性が低いことや翻訳後修飾が不適切な点である。発現産物が不溶性の合成物として沈着することは、きわめてよく起こる現象である。不適切な修飾は、進化の名残りである。細菌の細胞と真核生物の細胞とでは、糖鎖付加、硫酸化、タンパク分解による切断が異なることが多い。多重修飾のポリペプチドを作るためには、真核細胞系を選ぶのが最適である場合が多い。
酵母系―酵母系の長所は、酵母の培養が長年にわたって発酵法として一般的であり、技術が充分に確立している点である。多くの酵母ベクターの系が構築されており、そのほとんどが、発現を効果的にするために酵母の制御配列をもとにしている。硫酸化、糖鎖付加ともに効率的に行うことができるが(Moir & Dumais, 1987)、酵母での糖鎖付加は、高等真核細胞ほど正確でない場合もある。
培養細胞―培養細胞は、おそらくもっとも多種の発現系で宿主として用いられてきたと考えられる。DNAは、エレクトロポレーション法、化学的形質転換法、マイクロインジェクション(微量注入)法、ウイルスベクター法などを用いて導入することができ、哺乳類動物の細胞は、異種タンパク質の生成や治療用モノクローナル抗体の研究に幅広く利用されている。
昆虫細胞で主なベクター系として用いられるバキュウロウイルスは、昆虫の幼虫体内での通常の生活環の中でタンパク質ポリヘドリンを大量に産生する。多くの研究グループが、異種タンパク質の発現を促進するためにポリヘドリン遺伝子由来の制御配列を用いている(Luckow
& Summers,
1988)。バキュウロウイルスのゲノムは大きく操作が困難なため、タンパク質の生成効率を最大化するために、さまざまなベクター系が開発されてきた(Davies,
1994)。
動物―動物は「バイオリアクター」として使われてきた。乳腺や造血系で過剰に合成されるタンパク質は、組換えタンパク質の生成に回すことができる。こうした実験については、以下の「トランスジェニック動物の利用」で述べる。
組換えゲノムの利用
トランスジェニック動物
動物が家畜化されて以来、伝統的育種法が目指してきたのは、動物の性質を改変して人間にとってより「望ましい」ものにすることだった。その第1段階として行われたのは「野生の」行動様式をなくすことであり、最近の例では、動物1頭あたりの乳汁の生産は1945年から1983年の間に2.5倍に増加した(Seidel, 1986)。形質転換でも、同様の変化を生みだそうとする場合があり、表現型に微妙な変化あるいは劇的な変化をもたらす手法がある。
1.
形質転換では、ある動物が持つ既存の形質の「改良」を促す場合がある。こうした場合、すでにある有用系統の望ましい形質を固定することを意図した現行の育種法を迂回し、改良するために、形質転換が用いられる。このため、トランスジェニック法は、家畜種の成長を促進するのに用いられることもある(Pursel
et al., 1989)。
2.
形質転換では、ある種にまったく新たな性質を導入する場合もある。この方法では、トランスジェニック動物が異種タンパク質を産生する場合もあれば(たとえば、有蹄類の乳汁中の医薬品タンパク質など(Archibald
et al., 1990; Ebert et al., 1991; Wright et al.,
1991))、新たな病害抵抗性を与えたり(Salter & Crittendon, 1989; Erickson &
Izant, 1992)、新たな組織適合性抗原や抗体を産生するように免疫系を改変したり(Brüggemann et al.,
1991)、あるいは新たな消化能を与えて消化の悪い飼料の熱利用を向上させたりする(Hazlewood & Teather, 1988)。
トランスジェニック動物のいくつかの例を表7.3に挙げる。
表7.3 主なトランスジェニック動物
|
種 |
導入遺伝子 |
望ましい・期待 |
注釈 |
参考文献 |
|
マウス |
MT/hGH |
成長促進 |
遺伝子導入による表現型が示された最初の劇的な例 |
Palmiter et al., 1983 |
|
マウス |
MT/GHRH |
成長促進 |
繁殖力が向上 |
Hammer et al., 1985a |
|
ブタ |
MT/GH |
成長促進 |
成長率が向上 |
Hammer et al., 1985b; Vize et al., 1988; Pursel et al., 1990 |
|
ヒツジ |
BLG/α1-AT |
乳汁中での医薬品生産 |
35〜60 g/l のタンパク質 |
Wright et al., 1991; Clark et al., 1992; Carver et al., 1993 |
|
ヤギ |
WAP/LAtPA |
乳汁中での医薬品生産 |
3 mg/l のタンパク質 |
Ebert et al., 1991 |
|
ニワトリ |
RSV-MT/bGH |
成長促進 |
100 μg/l のタンパク質 |
Chen et al., 1990 |
|
ニワトリ |
ウイルス抵抗性 |
レトロウイルスベクターによるイネ縞葉枯病ウイルス(RSV)抵抗性 |
Salter & Crittendon, 1989 |
|
|
魚類(コイ) |
成長促進 |
トランスジェニックの魚の約20%で有効 |
Zhang et al., 1990 |
略語の解説:
ALV:−トリ白血病ウイルス、bGH:ウシ成長ホルモン、BLG:β-ラクトグロブリン、env:エンベロープ上の糖タンパク質をコードする遺伝子、GHRH:成長ホルモン放出ホルモン、hGH:ヒト成長ホルモン、LAtPA:持続型組織プラスミノーゲン活性化因子、MT:メタロチオネイン、RSV:ラウス肉腫ウイルス、rtGH:ニジマス成長ホルモン、WAP:乳清酸性タンパク質、α1-AT:α1-抗トリプシン
組換えタンパク質
組換えタンパク質は、現在使われている「天然」タンパク質と同じくらい幅広く利用されている(表7.4)。醸造やチーズ製造から医薬品の製造に至るまで、どのような工業プロセスでも、組換えタンパク質あるいはそうしたタンパク質を産生する微生物を利用することによって改良できる可能性がある(Enari, 1991; Gill & Zaworski, 1991)。実際に英国では、チーズ製造に遺伝子組換えのレンニンが使われたり、パンの製造やビールの試験生産に組換え酵母が使われている。米国食品医薬品局(FDA)は、1991年の時点で、十数件の治療薬とワクチンを承認し、rDNA由来の治療薬やワクチンの臨床試験を800以上認可していた(Miller, 1991)。1992年半ばまでには、こうした医薬品40数種類の使用が複数の国で承認された(Bienz-Tadmor, 1993)。このように、組換えタンパク質は、工業面や臨床面で充分に生活に根づいている。
表7.4 主な組換えタンパク質
|
有用タンパク質 |
疾病/病原体 |
産生系/ベクター系 |
参考文献 |
|
インスリン |
糖尿病 |
プラスミド/大腸菌 |
Goeddel et al., 1979a |
|
(削除) |
コレラ |
Vibrio cholearaeの欠失変異体 |
Levine et al., 1988 |
|
O抗原 |
コレラ |
Salmonella typhi |
Tacket et al., 1990 |
|
HIV抗原 |
エイズ |
ワクシニアウイルス |
Moss, 1991 |
|
HIV抗原 |
エイズ |
BCGワクチン |
Stover et al., 1991 |
|
神経毒 |
植物病虫害 |
バキュロウイルス |
Tomalski & Miller, 1992 |
組換えタンパク質をワクチンや生物農薬として利用することによって、多くの新たな機会が生まれる。組換えワクチンに対する生物の反応の研究によって、細胞性免疫系や体液性免疫系の相対的な寄与についての理解が深まると同時に、組換え抗原を免疫系に提示する最適の方法が明らかになっている。ワクチンの生産には、病原体から病原性を与える遺伝子を削除する方法と、病原体の主要抗原をコードする遺伝子を非病原性ベクター(ワクシニアウイルスやアデノウイルスなど)に挿入する方法の大きく2つがある(Moss,
1991; Jacobs, 1993)。
弱毒化した生ワクチンは、人や動物での予防法として一般的に使用されており、こうした利用は、GMOの最も大規模な導入で非常に大きな成功を収めた例とみなすことができる(Miller,
1991)。欧州では、キツネの個体群に狂犬病が持ち込まれることがよくある。弱毒ワクチンを用いた予防活動では、齧歯類(また、米国の場合、主な媒介動物であるアライグマ)では使用されたワクチンの病原性が残っており、病原性が復帰する可能性のあることが明らかになった。大規模環境試験では、組換えワクシニア−狂犬病表面糖タンパク質ワクチンが、ベルギー南部区域2,200km2のキツネ個体群における狂犬病の根絶に高い効果を示したことがわかった(Brochier
et al., 1991)。この試験のあと、世界保健機構(WHO)によって、経口狂犬病ワクチンの研究・試験が勧告された(WHO, 1989)。
有害節足動物による作物の食害は、世界中で大幅な生産の減少をもたらしている。こうした有害種のウイルス病原体を予防する可能性として、バキュロウイルスに重点が置かれているが、これはバキュロウイルスが安定的、効果的で、種特異的なためである。しかし、通常のウイルス感染の場合、ウイルスが複製している数日間は、宿主は生きたまま餌を食べ続けることができる。上述したのと同様のウイルスベクターは、宿主をより迅速に無力化あるいは死滅させる遺伝子が発現するように改変することが可能である(Tomalski
& Miller, 1992)。このほかに、宿主が感染後に摂餌を続けることを可能にするウイルス遺伝子を取り除くという方法もある(O'
Reilly & Miller, 1991)。こうした高度な方法によって、安全で効果的に有害生物を防除する可能性が大きくなってきた。
現行の規制
規制の経緯
規制は、遺伝子組換えが行われている国の数と同じだけ存在する。1991年、国連工業開発機関(UNIDO)は、組換えDNAに関するガイドラインの国際的な統一化を図ることを目的とした取り組みの一環として、「生物の環境放出に関する自主行動基準」(UNIDO,
1991)を公表した。英国では、2つのEU指令(CEC, 1990a, b)、および11の手引書(Note of
Guidance)が付随する遺伝子改変規制(Genetic Manipulation Regulations:ACGM/HSE,
1989)に加えて、GMOの作出と放出に関する議会制定法が9つある。オーストラリアでは、23の厳しい規制が課されている。多くの国が、現行の法律(動物衛生、環境、食品、化学物質に対する規制など)を使ってGMOの利用のさまざまな側面に対処しようとしており、これらを補うために追加の規制を制定してきた。こうした選択は、いろいろな意味で合理的である。先にも説明したように、組換え製品は、ほとんどの場合、従来技術を使った他の新製品によって生じるのと異なるリスクを示すことはない。この考え方を受け入れるなら、問題となっている安全面、つまり、生物の放出、個人の安全、食品や医薬品の安全性は、現行の法律の対象になるということである。要件として重要なのは、それぞれの国がこの問題に取り組み、評価の体系を確立することである。
規制は、プロセスと製品という大きく2つの陣営に分かれてきた。多くの国では、実験室レベルでの遺伝子操作(すなわち、GMOを作出するプロセス)を規制する方法を選択し、次いで、この規制を大規模利用や放出に拡大してきた。英国はおおむねこうした経緯を経ており、個々のGMOに対する評価(下記を参照)が適用されている。これに対して米国では、相当の議論を経て、いまだに異論は多いものの、生物の性質(製造方法への重点は低い)とその予定放出区域を審査することによってリスクに対処するという、リスクに基づく環境試験の監視方法を確立してきた(Medley,
1992; Miller et al., 1990; Miller, 1991)。
GMOの作出における安全性
法律がもっとも慎重に検討されなければならない分野はGMOの作出と評価だが、それは、GMOが新規で性質が不明なのがこの段階だからである。英国の場合、規制と付属の手引書が最初に立案されたのは、1970年代から1980年代初めにかけてである。実験規模での作業の危険性に対する認識が高まり、もともとあったガイドラインの多くが修正された(ACGM/HSE,
1989)。とはいえ、こうした規制でも、外来DNAの発現によるリスクがある場合には、その分類を上のレベルに上げるようになっている。同様に、タンパク質産物が毒性を有する場合には、いっそう高レベルの分類が求められる場合がある。その場合、安全基準の評価を適切に行い、場合によって緩和するためには、操作されるDNA配列に関する基本的な理解が欠かせないことは明らかである。そのタンパク質の「侵入性」(すなわち、GMOやそのDNAが人体に入り込んで生存する可能性)を示す要素の任意の尺度を用いれば、タンパク質の「発現性」(ベクターの部位がタンパク質のクローンを作るように意図されているかによって規定される)とそのタンパク質による「損傷性」(作業者の健康に対するリスクの指標)が組み合わさって相対リスクの評価が得られ、これによって、実験は4つの階級のうちの1つに分類することができる。この分類は、非組換えの病原体を用いる作業を基にしたものである。
英国で採択された手引書(ACGM/HSE,
1989)のうち2つ(1と5)は、発癌性の核酸配列と真核細胞のウイルスベクターを規制するものである。ヒトへの感染の可能性があるため、こうした系の使用に関する規制は厳しくなっている。しかし、GMOを扱う実験を原因とするヒトへの感染は明らかになっていないことに注意すべきである。
封じ込め利用と放出
安全性委員会および評価委員会
放出を実施しようとする者は、可能な限り、放出計画の立案時に最大限の配慮をするべきである。そのためには、放出を行う種がトランスジェニックかそうでないかにかかわらず、懸念を引き起こすのに充分な新規性を持つ放出について審査するために、幅広い関心を持つ専門機関が必要になる。そうした機関の役割は、放出問題に関する専門知識を発揮することである。英国の場合、そのような委員会には、放出を計画する人々が多く参加するのはもちろん、研究機関を管理する立場の人間も参加するが、これは安全性への責任がこうした人々にあるからである(Royal Commission on Environmental Pollution, 1991)。さらに、こうした機関には、次のような分野の専門家が参加することも重要になるだろう。
1. 遺伝学
2. 生態学
3. 安全性
4. 分子生物学
5. 植物学
6. 昆虫学
7. 環境衛生
米国の場合、こうした委員会には倫理学者(哲学や宗教の学問的背景を持つ人)が参加するのが一般的である。
委員会の役割は、放出区域の安全が確保されているかを調査すること、既成概念にとらわれずさまざまな角度からリスクを予見するために自分たちのスキルを活用すること、そしてそのリスクの重大性とそれによって生じる結果を評価するように努めることである。初期の段階では、放出案について国民が知らされていることが重要である。放出案を検討する際の開放性は、認められる有害性とそれが起きる可能性の評価法に関する情報を国民に提供し、あらゆる妥当な予防策が取られていることを国民に納得させるのに重要な要素である。
組換えゲノムの封じ込め利用
多くのトランスジェニックの動物種では、研究段階での封じ込めは、家畜学優良規範の一環としてすでに実践されている。通常、研究用動物に野生近縁種が近づかないようにするために、特別の配慮がなされる。同様に、特にこの段階ではそれぞれの動物がきわめて「貴重」であるため、環境中への逸脱が起こらないようにするための配慮も行われる。また、研究区域に一般的な害虫が接近するのを防ぐために、従来の害虫防除法も用いられるべきである。こうした制限は、すべてのトランスジェニック動物種に適用される。封じ込めが容易でない生物、たとえば昆虫類や魚類などは、特に注意して維持すべきである。オーバーンにあるアラバマ農業試験場(米国アラバマ州オーバーン)でのトランスジェニックのコイの研究についての評価によると、封じ込め施設への組換え魚の放出では重大な影響はないことがわかった(USDA, 1990)。67ページに及ぶその評価報告によると、試験場では5つの封じ込め法を検討し、コイの逸出につながる洪水などの側面を考慮に入れた。トランスジェニックのナマズの封じ込め放出に関する同様の案も、同等またはより厳しい評価の対象になった(Fox, 1992)。
組換えゲノムの放出
トランスジェニック動物の潜在的有害性
新規の遺伝子型の環境への放出には、数百年の歴史がある。生物的防除の分野では、農学上の重要作物に害を及ぼす生物を根絶する試みの一環として、数百に及ぶ生物が各地で新たに放出されてきた(DeBach
& Rosen,
1991)。放出で最初の成功例の1つが、ワタフキカイガラムシの防除を目的として1888年から89年にかけてカリフォルニアで行われた、ベダリアテントウの放出である。テントウムシに関する長い研究の末、ようやくオーストラリア産の適当な種が選択されるに至った。もっと最近の例では、コナカイガラムシ防除のための大規模な試みがアフリカで行われている。この例での捕食動物は、南アフリカ原産の生物であるEpidinocasis
Lopeziである。
こうした放出の歴史では、多くの成功が収められてきた。失敗もあったが、そのほとんどは、捕食者と被捕食者、あるいは宿主と寄生生物の関係についての理解が不充分な場合だった。こうした試み(過去数百年にわたって行われてきたものの多く)から得られた大きな教訓は、放出が行われる場所の生態系について充分に理解することが不可欠だということである。最も重要なのが、宿主集団(植物や動物)の生態系と、その有害生物との関係である。封じ込め施設内で新しい防除剤の有効性を評価することも非常に重要である。リスクを最小限に抑えるためには、こうした段階を経ることが不可欠であることはもはや明らかである。
成功した導入(さらには失敗に終わったもの)をみると、生態系に関する背景知識が必要であることが強調されている。まったく新規の(外来)遺伝子型の環境への導入は、ほとんどの場合、トランスジェニック生物の導入よりもはるかに極端な影響をもたらす。トランスジェニック動物の放出によって生じる有害性に関するデータは、いくつかの分類に基づいて求めることができる(表7.5)。トランスジェニック生物の性質の多くは、実験室や研究区域での評価を通じて、同種の非トランスジェニック個体と比較することができ、封じ込め状況での摂食行動、性行動、攻撃行動、移動を評価することが可能である。こうした有害性のいくつかは、一部の試験には関連性が低いことは明らかだが、ほとんどの国の規制で検討することが求められている。
表7.5 遺伝子組換え生物(GMO)の放出による潜在的危険性【脚注a】
|
1. 生物について |
宿主の性質 |
|
2. 環境について |
区域の規模および場所(所有および安全性を含む) |
|
3. 定着および伝播 |
人為的ストレスに対する感受性 |
|
4. 安全性 |
区域での作業者の安全性および作業者への教育 |
【脚注a】GENHAZの提言に基づく(ACGM/HSE, 1989)
組換えタンパク質の潜在的危険性
組換えタンパク質に付随する有害性は、ほとんどの場合、そのもとになる産物に付随する危険性と同種のものである。ヒトの場合、アレルギー反応や、現在使われているインスリンなどの治療薬の使用によって生じるような副作用といったリスクがある。こうしたリスクは、組換え遺伝子技術を使うことによって増大する。
食品の安全性については、現在いくつかの機関が取り組んでいる(WHO, 1991; OECD,
1992)。最近の懸念は、乳汁の生産を上げるためにウシ成長ホルモン(ウシソマトトロピン、bST)を使用することや、魚の「毒性」遺伝子が活性化する可能性など、多種多様な分野にわたっている。ウシソマトトロピンを注射することによって、乳牛の乳汁生産を10〜15%増加させることができる。ヒトの健康への懸念は、使用されるbSTによる影響がないかどうかに絞られる。実際のところ、成長ホルモンは、摂取すると不活性化され、この点に関する懸念は充分解消していると思われる(Juskervich
& Guyer, 1990)。
魚の場合は、問題がより複雑である。導入遺伝子の組み込みや発現の影響で魚の毒素遺伝子が活性化する可能性はないだろうか。こうした心配がされるのは、魚が毒素遺伝子を含んでいるのではないかという疑いがあるためだが、現状では、そうした証拠はない(Berkowitz
& Sørenson,
1994)。たしかに、一般的な食用魚種から毒素が検出されたことはなく、有毒魚(フグなど)においてさえ、毒素を産生するのは共生細菌だと考えられる。
新規の方法では、望ましくない結果や副作用が生じる可能性があることを考慮することが重要だが、現在行われていることに照らしてリスクのレベルを検討するという合理的な方法によって、こうした可能性に対処することも重要である。
安全性とリスクの評価―トランスジェニック動物
トランスジェニック動物
英国では、現在、放出の準備手続きはGENHAZシステムの対象になっている(Royal Commission on
Environmental Pollution,
1991)。これは、化学工業の評価システムをもとにしたもので、評価者に対して、たとえどんなに起こりそうになくても、放出による潜在的影響を検討させ、さらに重要な点として、可能な限り正確に結果を予測させることを意図している(表7.6)。本章の執筆時点で、このプロセスは見直しの最中であり、英国のバイオテクノロジー規制は、「用心が度を超しており、時代遅れで、非科学的であり、学術研究者にも企業にも不必要な重荷を課している」として、上院の科学技術特別委員会の批判を受けているところである(UK
House of Lords's Science and Technology Select Committee,
1993)。新たな案では、「経験」と「ファミリアリティ」に重点を置いた簡素化された手法と、潜在的有害性のある利用や非常に新規な利用に限って厳密な検討を行うことが提案されている。ただ、国内での実績のない新規ゲノムの放出に適用できる原則を調べることは有益である。理解と精通の度合いが上がるにつれて、こうした厳格な手法は必要でなくなるだろう。基本的な要素は、こうした疑問点を生成するのに役立つ一連のキーワードや参照語(guide
word)である。そうした参照語の1つが「WHERE
ELSE(どこか別の場所で)」というものだが、これは解説が必要かもしれない。DNAが本来の導入部位以外の場所で検出された場合、何が起きるだろうか。目的部位以外の組織で発現が起きた場合、何が起きるだろうか。意図した放出区域以外の場所でその生物が見つかった場合、何が起きるだろうか。広範な知見を背景として、こうしたキーワードと参照語の組み合わせを検討することによって、起こりうる(と同時に起こり得ない)結果の大部分は明確になるはずである。
GMOの放出による影響は、その生物が速やかに回収できない場合に、より深刻になることは明らかである。トランスジェニックの魚は、その典型的な例である。魚類の系統には、成長ホルモン(GH)遺伝子や寒冷耐性遺伝子が導入されてきた。そのどちらも実験段階では成功していると考えられる。つまり、GH遺伝子を含んだトランスジェニックの魚は、非トランスジェニックの近縁種よりも大きくなり、同様に、耐冷遺伝子を用いることによって、寒冷耐性に優れた魚が得られている。
表7.6 GENHAZの概要
|
遺伝子組換え系の構成要素 |
|
コンストラクト―rDNAの構成要素 |
|
放出の段階 |
|
受容体の“作出”または“選択”、コンストラクトの作成、産物の作出 |
|
GENHAZの手続き |
|
“逸脱”を生成するための参照語の適用 |
|
参照語(Guide word) |
|
NOまたはNOT 計画の完全な打ち消し(遺伝子がベクターに導入できない場合など) |
GENHAZ65に含まれる提言に基づく
直感的に考えて、こうした個体群のどちらも自然生態系に脅威を与える、つまり、その大型の魚は摂食行動がより積極的で、水が冷たい場所では耐冷性の魚が自然種に取って代わることが想像できる。トランスジェニックのコイの封じ込め放出では、これに反する事実がいくつか出ている(USDA,
1990; Fox, 1992)。
つまり、周到に計画された放出においては、生態系バランスに影響する人為的な要因だけではなく、(おそらくはもっと重要な)自然の生物学的バリアをも明らかにすることが可能である。通常、GMOは弱いため、自然の近縁種の在来系統について、つまりどのような種類のバリアが働くかは、必要ならばある程度詳細に調査することが可能である。
リスク評価においては、研究機関とは独立の管轄当局によって審査が行われるべきである。通常、国の審査機関が設立されるが、現在はもちろん、今後も重要性が高まるのは、そうした国の機関がお互いに連絡を取り合うことである(以下を参照)。国の諸機関が連絡を取り合うことによって、過去の実績をもとに審査を簡素化する際の情報の共有が可能になる。放出の審査のために設置される委員会のメンバーが持つ多くの専門知識をそれぞれの機関が所有することになり、さらには、国内の法規制を審査する担当者の参加が得られることになる。
安全性およびリスクの評価―組換えタンパク質
世界中の多くの国は、新規の食品、医薬品、バイオ工業製品を評価するためのガイドラインを設けている。これらの評価手順では、新たな治療薬の評価に何年もかかる場合があるが、遺伝子操作によって作成されたタンパク質の評価を行うための手法の大部分あるいはすべてはこの手順に示されている。実際、組換えタンパク質は、従来手法で生産された新製品よりも、もとになる製品との類似性のほうが高いことが多い。ところが現在EUでは、遺伝子操作によって得られた食品に対して新たなレベルの監視をしようという提案がなされている。これに対して、米国FDAやOECDは、新たな食品はその性質の新規性を基準に評価すべきであるとの判断を示してきた。これが実行されるにつれて、製品の性質や個々の製品における影響から考えると、より妥当なのはこちらのアプローチであると思われる。
最近、米国では、新規の医薬品を評価するための新たなガイドラインが導入されている。エイズ団体からの経験や知識に基づく率直な批評に促された面もあって、FDAは、試験・承認の迅速化を通じて新規医薬品の発売を促進しようとしている。この例は、慎重かつ極度に綿密な承認を意図した規制体系は、死に直面している個人にとって苛酷な場合があることを、先進諸国に気づかせるのに役立った。通常、規制やリスク評価は費用と便益の均衡政策であり、個人が負う費用が時には絶対であることを認識する必要がある。
放出後の影響
放出を管理することによって、数回の繁殖シーズンを通じてGMOの性質を判断する時間が与えられる(図7.2)。実験室での試験によって、GMOの挙動に生じうる変化の多くが明らかになるが、挙動を充分に評価することができるのは、より自然に近い環境においてである。必要が認められる場合には、封じ込め放出を行うことによって、自然種との競合状態での挙動を調査することができる。こうした考え方の多くは、通常の優良農業規範の一部のはずである。在来の動物や魚類の新しい系統は、通常、既存の生物に代わって大規模に使用される前に試験が行われる。たとえばトランスジェニック以外の手段によって牛の乳汁生産を増加させようとする場合、表現型の安定性を判断し、生物への有害な影響を見出すために、そうした評価を数世代にわたって行うことになる。あらゆる伝統育種法では、満足のいく育種系統が確立されるまでに、こうした手順が不可欠である。同じように、充分に新規で、性質がその親動物と充分に区別できるGMOの管理された放出によって、こうした相違による影響を調査する機会が与えられる。
つまり、伝統育種法での常識は、主な動物の異種交配によって生みだされる系統と同じように、GMOの常識にもあてはまる。水産養殖の場合、新規の食用種の導入には、遺伝子改変魚の系統を使用するのと同様の注意と配慮が必要である。
まとめ
生物学、常識と放出
トランスジェニック動物や組換えタンパク質の章を執筆する上で困難なことの1つは、組換えゲノムという分野が、きわめて広範な技術、計画、期待、そして有害性を包含する領域であることが極めて明らかな点である(同様に、読者にとっても明らかだと思う)。伝統育種法や品種改良法がお互いに共通点があるのと比べると、これらの手法には相互の共通点があまりないことが多い。こうした手法で改変された生物に付随するリスクを検討する場合、生物学的な原理や指導原理によれば、有害性を主に決定するのは動物やタンパク質の性質であって、その動物やタンパク質を得た手段ではないはずである。この議論を受け入れることは、現行の法律を使って組換えDNAの放出の規制が行えることを意味することになるだろう。遺伝子操作の産物は、ほとんどの場合、伝統的方法で作られた新規の食品やタンパク質、作物と比較することができるが、「伝統的な」製品についてよりもGMOで起こっている遺伝的変化のほうが、はるかによくわかっている点だけは異なる。大部分の国には、有害性、病原性や外来性の生物、承認されていない医薬品や化学物質、さらにそれらの試験に対して適用される法律がある。おそらくそうした法律によって、充分な規制監視ができると考えられる。外来の(非改変の)生物の管理がどのくらい難しいかは、過小評価すべきでない問題である。米国には毎年、さまざまな非意図的な導入によって有害と考えられる生物が11種前後入り込んでおり、そのうち7種は害をもたらしている可能性が高い(DeBach & Rosen, 1991)。人為的な側面もある。1986年にUSDAは、持ち込まれようとした約50,000の外来生物の侵入を港の税関で阻止した。農業や工業で「伝統的に」行われている手法が、同じ問題に対するバイオテクノロジー手法に比べて精巧さに欠け、より有害性を持つかもしれないことを思い起こすことが重要である。
|
|
|
 |
基本的な生物学の疑問に対する回答 “挙動”に関する理解 “自然の”挙動に関する試験 完全発現の際の行動 |
左側の矢印で示したように、評価は継続的なプロセスである。GMOに関して大きな不確定要素が存在するのは、研究・開発の段階、特に遺伝子改変の安定性と表現型の安定性の関係である。GMOの性質が充分に明らかにされて放出が検討できるようになるまでには、これらの疑問(主にGMOに固有なもの)への回答がなされているべきである。封じ込め放出と完全放出の段階で残っている疑問は、あらゆる新規の遺伝子型に付随する疑問である。GMOの場合、こうした評価において精通性(ファミリアリティ)が大きな役割を果たす可能性がある。
遺伝子操作に関する国民の認識は、これとは対照的であるに違いない。遺伝子操作によって作り出された変化は、伝統的手法によって生みだされる変化よりも精緻で、予測可能性が高く、より性質が明らかなことが多いということを、国民、つまり消費者が認識することが重要である。しかし、倫理的な理由を背景に、すべての動物、あるいは特定の動物の使用に反対するグループが多くあることを念頭に置く必要がある。こうした人々の一部にとって、ある種の遺伝子操作は、断じて受け入れがたいものであるかもしれない。英国の敬虔な宗教団体の多くは、ブタの配列をもとにしたDNAを含む食品は、たとえそのDNAが試験管内で合成されたものであっても、受け入れないだろう。しかし、伝統的手法と組換えの手法の性質についておよび外来DNA(実際には、ほとんどが大腸菌内で作られる)の存在について教育を行うことは、組換えDNAが宿主生物の性質を根本的に変えるものではないことを、人々に改めて確認させるのに役立つ可能性がある。
しかし、最近、規制に関する議論は高まってきている。米国では、およそ1,000件の遺伝子改変植物の放出または移動で得られた経験から、規制による「・・監視は、従来の植物に対してこれまで適用されてきた監視と同等の、潜在リスクがあるという科学的徴候に見合ったものにすべきである」という提案が行われるようになってきた(Hunter
et al.,
1992)。しかし、FDAが主導する政策はいまだ立案中であり、ジェレミー・リフキンが主導する圧力団体のピュアフード運動や、最近では、憂慮する科学者同盟が、国民の議論を再燃させ、それをトランスジェニック製品反対へと向けようとしている(Hoyle,
1992, 1994)。欧州の規制に対する批判が起きたのは1989年で(Millier,
1991)、それ以来、厳格な規制の必要性とその投資に及ぼす影響に関する議論が盛んに行われている(Young & Miller,
1989; Hodgson, 1992; Kathuri et al.,
1992)。現在は、多くの放出が、もともと提案された規制よりはプロセスに基づく度合いの少ない新たな規制のもとで行われることになるとみられる。ただし、こうした案を部分的にでも承認しているのは、12のEU加盟国のうち6カ国だけである。
投資機会に関する企業の見方にとって、規制による決定はきわめて重要な要因であることを認識する必要がある。ドイツのバイエルとデンマークのノボ
インダストリーの両社は、厳しい規制への対応の一環として、国外に大規模な研究開発施設を設立した。つまり、規制の問題には2つの側面がある。規制がきわめて厳格だと、投資は抑えられる可能性がある。反対に、バイオテクノロジー企業は、規制の枠組みが設けられていない国にも投資を控える。必要なのは、各国が、国内のニーズに対処すると同時に、一般的な政治的、社会的問題である国際的な視野に立った枠組みを設けることである。また、最近、議論されているのは、途上国にとってのバイオテクノロジーには社会、経済、技術のさまざまな意味合いがあるという点である(DaSilva
et al., 1992)。
法律の立案
こうした社会・経済上の制約を念頭に置いた上で、法律の立案方法や、新たな法律に何が必要かを自らに問いかけてみることが有用かもしれない(表7.7)。その出発点は、現行の法律を検討して、GMOの放出に関する大部分、できればすべての側面をカバーすることができるかどうかを判断することである。すべての国は、GMOの作出に関する安全性やリスクの評価は、法律を必要とする特殊な区分を形成すると考えている。これは、多くのクローニング実験で、作りだされた産物の正確な性質を予測することができないという考えに基づいている。トランスジェニック動物やタンパク質の放出や使用に関しては、多くの国が現行の(おそらくは改正された)法律を運用している。そうした法律として、英国では環境保護法や食品環境保護法などがあり、米国の場合、バイオテクノロジーによる製品を規制するのに現行法(動物検疫法など)で充分であることが、バイオテクノロジーの規制に関する調整された枠組みによって規定されている。
適切な現行法がない場合、本書での議論や、「生物の環境への放出に関する自主行動規範(Voluntary Code of Conduct for
the Release of Organisms into the Environment(UNIDO,
1991)による指針が、一般的な原則としての枠組みを提供する。
国際的な情報源
複数の国際機関が国際間のバイオセーフティーの整合化や統一化を図ろうとしているが、それはこの問題が国境を越えた懸念にならざるを得ないからである。UNIDOは、「生物の環境への放出に関する自主行動規範」(UNIDO, 1991)をまとめるための委員会の召集を主導し、遺伝子工学・バイオテクノロジー国際センター(ICGEB)の傘下に、先進国と途上国の間の技術移転を支援することを目的とした研究施設をトリエステとニューデリーに設置した。ICGEBは独立の政府間機関で、その加盟国によって「所有」され、柔軟な対応によって加盟諸国のニーズの変化にもすばやく対応する。また同センターは、世界中のデータベースの多くにアクセスすることのできるICGEBネットというコンピュータネットワークを維持している(Simon & Pongor, 1992)。さらに、UNIDOはバイオセーフティー情報ネットワーク・アドバイザリーサービス(BINAS)を設置しており、この機関は多くの国での国内拠点を指定している。これらBINASの国内拠点は、バイオセーフティーを管轄する当局に対して専門知識や情報の支援を提供することになっている。このように、効率的な情報ネットワークが、バイオセーフティー規制の制定や運営にかかわる中核レベルで設置されるように計画されている。こうしたルートを通じて、情報と専門知識が、公式に、そしてさらに重要なのは非公式にも、交換されることになる。放出を計画している規制当局や国がリスト化されることによって、情報の普及、手続きの合理化、作業の重複の排除への動きが加速する。存在しなかったり重要でない憶測上のリスクに対する不必要な法律上の負担を取り除いて規制をスリム化するためには、健全な生物学的原理に基づいた安全に対する姿勢を維持すること、世界中に現在ある情報や今後数年のうちに得られる情報を利用することにバイオセーフティー規制の重点が置かれなければならない。
表7.7 放出に関する法律のためのチェックリスト
|
謝辞
必ずしも筆者と見解が一致するものではないが、本章の作成を助けてくれた多くの人々に感謝したい。特に、きわめて有益な情報を寛大にも提供してくれた米国食品医薬品局のHenry I. Miller、農業害虫衛生検査局(Agriculture, Pest and Health Inspectorate Service)のTony Medleyに感謝する。Gilbert Howe、Morris Levin、Phil Dale、George Tzotzos、1992年12月にトリエステのICGEBで行われたUNIDO講座の講義、そして激励してくださったBrian Heap教授にも感謝する。また、原稿のタイプを担当してくれたDianne StylesとLinda Nottonにもお世話になった。
参考文献
ACGM/HSE (1989) Genetic Manipulations and Supplementary Notes of
Guidande
(1-1 1 ). Health and Safety Executive, London.
Anderson, W.F. (1992) Human gene therapy. Science, 256, 808-813.
Archibald, A.L., McCleneghan, M., Hornsey. V., Simons, J.P. & Clark, A.J. (l990) High level expression of biologically active human α1-antitrypsin in the milk of transgenic mice. Proc. Natl. Acad. Sci. USA, 817, 5178-5182.
Berkowitz, D.B. & Sørenson、 I.K. (1994) Transgenic fish - safe to eat? Bio/Technology, 12, 247-252.
Bienz-Tadmor, B. (1993) Biopharmaceuticals go to market: patterns of worldwide development Bio/Technology, 11, 168-172.
Bradley, A. (1993) Site-directed mutagenesis in the mouse. Recent Prog. Horm. Res, 48, 237-251.
Brinster, R.L., Chen, H.Y., Trumbauer, M., Senear, A.Y., Warren, R. & Palmiter, R.D. (1981) Somatic expression of herpes thymidine kinase in mice following injection of a fusion gene into eggs. Cell, 27, 223-231.
Brinster. R.L. Sandgren, E.P., Behringer. R.M. & Palmiter. R.D. (1989) No simple soluton for making transgenic mice. Cell. 59, 239-241.
Brochier, B., Kieny, M.P., Costy, F., Coppens, P., Bauduin, B., Lecoq, J.P., Languet, B., Chappuis, G., Desmettre, P., Afiademanyo, K., Libois, R. & Pastoret P.-P. (1991) Large-scale eradication of rabies usiug recombinant vaccinia-rabies vaccine. Nature, 354, 520-522.
Bruggemann, M., Spicer, C., Buluwela. L., Rosewall, I., Barton, S., Surani, M.A. & Rabbits, T.H. (1991) Human antibody production in transgenic mice: expression from 100 kb of the human lgH locus. Eur. J. Immunol. 21, 1323-1326.
Carver, A.S., Dalrymple, M.A., Wright, G., Cottom, D.S., Reeves, D. B., Gibson, Y.H., Keenan, J.L., Barrass, J.D., Scott, A,R., Colman. A. & Garner, I. (1993) Transgenic livestock as bioreactors: stable expression of human α1-antitrypsin by a flock of sheep. Bio/Technology, 11, 1263-1270.
CEC (1990a) Council Directive of 23 April 1990 on the contained use of genetically modified microorganisms. Reference no. 90/219/EEC. Official Journal L117, Volume 33, 8 May 1990. Commission of the European Communities, Brussels.
CEC (1990b) Council Directive of 23 April 1990 on the deliberate release into the environment of genetically modified organisms. Reference no. 90/220/EEC. Official Journal L117. Volume 33, 8 May 1990. Commission of the European Communities, Brussels.
Chen, H.Y., Garber, E.A., Mills, E., Smith, J., Kopchick, J.J., DiLella, A.G. & Smith, R.G. (1990) Vectors, promoters and expression of genes in chick embryos. J. Reprod. Fertil., (suppl.) 41, 173-182.
Chen, T.T. & Powers, D.A. (1990) Transgenic fish. Trends Biotechnol., 8, 209-215.
Clark. A.J., Cowper, A., Wallace. R., Wright, G. & Simons, J.P. (1992) Rescuing transgene expression by co-integration. Bio/Technology. 10, 1450-1454.
DaSilva, E.J., Ratledge, C. & Sasson, A. (1992) (eds.) Biotechnology: Economic and Social Aspects. Issues for Developing Countries. Cambridge University Press, Cambridge, UK.
Davies, A,H. (1994) Current methods for manipulating baculoviruses. Bio/Technology, 12, 47-50.
DeBach, P. & Rosen, D. (1991) Biological Control by Natural Enemies, (2nd edn.). Cambridge University Press, Cambridge, UK.
Ebert, K.M., Selgrath. J.P., DiTullo, P., Denman. J., Smith, T.A., Memon, M.A., Schindler, J.E., Monasterski, G.M., Vitale, J.A. & Gordon, K. (1991) Transgenic production of a variant of human tissue-type plasminogen activator in goat milk Bio/Technology, 9, 835-838.
Enari, T.-M. (1991 ) Genetic modification of food and beverage yeast. Ann. N. Y Acad. Sci., 646, 181-192.
Erickson, R.P. & Izant, J.G. (eds.)(1992) Gene Regulation: Biology of Anti-sense RNA and DNA. Raven Press, New York.
Evans, M.J. & Kaufman, M.H. (1981) Establishment in culture of pluripotential cells from mouse embryos. Nature, 292, 154-l56.
Fox, J.L. (1992) USDA snarls at transgenic catfish. Bio/Technology, 10, 292.
Fox, J.L. (1993) NIHRAC okays gene therapy. Bio/Technology, 11, 1227.
Gandolfi, F., Lavitrano, M., Camaioni, A., Spadafora. C., Siracusa, G. & Lauria, A. (1989) The use of sperm-mediated gene transfer for the generation of transgenic pigs. J. Reprod. Fertil., Abstr. Ser. 4, 10.
Gill, G.S. & Zaworski, P.G. (1991) Use of yeasts in production and discovery of pharmaceuticals. Ann. N. Y. Acad. Sci., 646, 173-180.
Goeddel, D.V. (1990) Gene Expression Technology. Goeddel, D.V. (ed.) Methods Enzymol., vol. 185. Academic Press, San Diego, CA.
Goeddel, D.V., Heyneker, H.L., Hozumi, T., Arentzen, R., Itakura, K., Yasura, D.G., Ross, M.J., Miozzari. G., Crea, R. & Seeburg, P.H. (1979a) Direct expression in Escherichia coli of a DNA sequence coding for human growth hormone. Nature, 281, 544-548.
Goeddel. D.V., Kleid, D.G., Bolivar, F., Heyneker, H.L., Yansura, D,G., Crea, R., Hirose, T., Kraszewski, A., Itakura, K & Riggs, A.D, (1979b) Expression in Escherichia coli of chemically-synthesized genes for human insulin. Proc. Natl. Acad. Sci. USA, 76, 106-110.
Goto, M., Akai, K., Murakami, A., Hashimoto, C., Tsuda, E., Ueda, M., Kawanishi, G., Takahashi, N., Ishimoto, A., Chiba, H. & Sasaki, R. (1988) Production of a recombinant erythropoietin in mammalian cells: host-cell dependency of the biological activity of the cloned protein. Bio/Technology, 6, 67-71.
Hammer, R.E., Brinster, R.L., Rosenfield, M.G., Evans, R.M. & Mayo, K.E. (1985a) Ex-pression of human growth hormone releasing factor in transgenic mice results in increased somatic growth. Nature, 315, 413 - 416.
Hammer, R.E., Pursel, V.G., Rexroad, C.E. Jr, Wall, R.J., Bolt, D.J., Ebert, K.M., Palmiter, R.D. & Brinster, R.L. (1985b) Production of transgenic rabbits, sheep and pigs by microinjection: Nature, 315, 680-683.
Hazlewood, G.H. & Teather, R.M. (1988) the genetics of rumen bacteria. In: The Rumen Microbial Ecosystem, Hobson, P.N. (ed.), pp. 323-341 . Elsevier Applied Science, Cambridge, UK.
Hodgson, J. (1992) Europe, Maastricht and biotechnology. Bio/Technology, 10, 1421-1426.
Hoyle, R. (1992) FDA’s slippery food policy. Bio/Technology, 10, 935-939.
Hoyle. R. (1994) A quixotic assault on transgenic plants. Bio/Technology, 12, 236-239,
Hunter, S.L., Arntzen, C., Beachey, R., Breuning, G., Qualset, C. & Vidaver, A. (1992) Re-vising oversight of genetically modified plants. Bio/Technology 10, 967-971 .
Huszar, D., Balling, R., Kothary. R., Magli, M.C., Hozumi, N., Rossant, J. & Bernstein, A. (1985) Insertion of a bacterial gene into the mouse germline using an infectious retroviral vector. Proc. Natl. Acad. Sci. USA, 82, 8587-8591.
Jacobs, S.C. (1993) A novel recombinant adenovirus vector expressing a flavivirus non-structural protein protects against lethal flavivirus challenge. Clin,. Sci., 85, 117-122.
Juskervich, J.C. & Guyer, C.G. (1990) Bovine growth hormone: human food safety evaluation. Science, 249, 875-884.
Kathuri. C., Polastro, E.T. & Mellor, N. (1992) Biotechnology in an uncommon market. Bio/Technology, 10, 1545-1547.
Kaufman, R.J., Walsey, L.C., Spiliotes, A.J., Gossels, S.D., Latt, S.A., Larsen, G.R, & Kay, R.M. (1985) Co-amplification and co-expression of human tissue-type plasminogen activator and murine dihydrofolate reductase in Chinese hamster ovary cells. Mol. Cell. Biol., 5, 1750-1759.
Lavitrano, M., Camaioni, A., Fazio, V.M., Dolci, S., Farace, M.G. & Spadafora, C. (1989) Sperm cells as vectors for introducing foreign DNA into eggs: genetic transformation of mice. Cell, 57, 717-723.
Levine, M.M., Herrington, D., Losonsky. G., Tall, B.,Kaper, J.B., Ketley, J., Tacket C.O. & Cryz, S. (1988) Safety, immunogenicity and efficacy of recombinant live oral cholera vaccines CVD-l03 and CVD-l03-HGR. Lancet, ii 467-470.
Love, J., Gribbin, C., Mather, C. & Sang, H. (1994) Transgenic birds by DNA microinjection. Bio/Technology, 12. 60-63.
Luckow, V.A. & Summers. M.D. (1988) Trends in the development of baculovirus expression systems. Bio/Technology, 6, 47-51.
Mcdley, T.L. (1992) Status of regulatory approval of biotechnology-derived plants and animals. Crit. Rev. Food Sci. Nutr., 32, 151-155.
Miller, A.D., Jolly, J.D., Friedman, T. & Verma, I.M. (1983) A transmissible retrovirus expressing human hypoxanthine phosphoro ribosyltransferase (HPRT): Gene transfer into cells derived from humans deficient in HPRT. Proc. Natl. Acad. Sci. USA, 80, 4709 - 4713.
Miller. H.I. (1991) Regulation. In: The Genetic Revolution, Davis, B.D. (ed.), pp. 196-211, The Johns Hopkins University Press, Baltimore. MD.
Miller, H.I., Burris, R.H., Vidaver, A.K. & Wivel N.A. (1990) Risk-based oversight of ex-periments in the environment. Science, 250, 490 - 49l.
Moir, D.T. & Dumais, D.R. (1987) Glycosylation and secretion of human α1-antitrypsin by yeast. Gene, 56, 209-217,
Moss, B. (1991) Vaccinia virus - a tool for research and vaccine development Science, 252, 1662-1667.
Notarianni, E., Laurie, S., Moor, R.M. & Evans, M.J. (1990) Maintenance and differentiation in culture of pluripotential embryonic cell lines from pig blastocysts. J. Reprod. Fertil, (suppl.) 41, 51-56
OECD (1992) Safety of Foods Derived by Modern Biotechnology: Concepts and Principles, OECD. Paris.
O’Reilly D.R. & Miller, L.K. (1991) Improvement of a baculovirus pesticide by deletion of the egt gene. Bio/Technology, 9, 1086 - 1089.
Palmter, R.D., Norstedt, G., Gelinas, R.E., Hammer, R.E. & Brinster, R.L. (1983) Metallothionein-human GH fusion genes stimulate growth of mice. Science, 222, 809 - 814,
Pursel, V.G., Hammer, R.E., Bolt, R.E., Palmiter, R.D. & Brinster, R.L. (1990) Integration, expression and germline transmission of growth-regulated genes in pigs. J. Reprod. Fertil., (suppl.) 41, 77-87.
Pursel, V.G., Pinkert, C.A., Miller, K.F., Bolt D.J., Campbell, R.G., Brinster, R.D., Palmiter, R.L. & Hammer, R.E. (1989) Genetic engineering of livestock. Science, 244, 1282-1288 .
Royal Commission on Environmental Pollution (1991) 14th report: GENHAZ. HMSO, London.
Salter, D.W. & Crittendon, L.B. (1989) Artificialinsertion of a dominant gene for resistance to avian leukosis virus into the germline of the chicken. Theor. Appl. Genet., 77, 457-467.
Seidel, G.E. Jr. (1986) Characteristics of future agricultural animals. In: Genetic Engineering of Animals, Evans, I.W. & Hollander, A. (eds.), pp. 299-310. Plenum Press, New York.
Simon, G. & Pongor, S. (1992) ICGEBNet: the UNIDO computer resource for molecular biology. Bioinformatics, 1, 12-19.
Stover, C.K., de la Cruz, V.F,, Fuerst T.R., Burlein, J.E., Benson. L.A., Benriett, L.T., Bansal, G.P., Young, J.F., Lee, M.H., Hatfull, G.F., Snapper, S.B., Barletta, R.G., Jacobs, J.R.Jr & Bloom, B.R. (1991) New use of BCG for recombinant vaccines. Nature, 351, 456-460.
Strueli, M., HalL, A., Boll, W., Stewart W.E.II, Nagata. S. & Weissman, C. (1982) Target cell specificity of two species of human interferon—a produced in Escherichia coli and of hybrid molecules derived from them. Proc. Natl. Acad. Sci. USA, 78, 2848-2842.
Swanson, M.E., Martin, MJ., O’Connell, J.K., Hoover, K., Lago, W., Huntress, V., Parsons, C.T., Pinckert, C.J., Pidler, S. & Logan, J.D. (1992) Production of functional human haemoglobin in transgenic swine. Bio/Thecnology, 10, 557-559.
Tacket, C.O., Forrest, B., Morona, R., Attridge, S.R., LaBrooy. J., Tall, B.D., Reymann, M., Rowley, D. & Levine, M.M. (1990) Safety, immunogenicity and efficacy against cholera challenge in humans of a typhoid-cholera hybrid vaccine derived from Salmonella typhi TY2la. lnfect. Immun., 58, 1620-1627.
Thomas, K.R. & Capecchi, M.R. (1990) Targeted disruption of tbe murine int-1 protooncogene resulting in severe abnormalities in midbrain and cerebellar development. Nature, 346, 847-850.
Tomalski, M.D. & Miller, L.K. (1992) Expression of a paralytic neurotoxin gene to improve insect baculoviruses as biopesticides. Bio/Technology, 10, 454-549.
UK House of Lords’ Science and Technology Select Committee (1993) Regulation of the United Kingdom Biotechnology Industy and Global Competitiveness. HMSO, London.
UNIDO (1991) Voluntary Code of Conduct for the Release of Organisms into the Environment. UNIDO, Vienna.
USDA (1990) Availability of an environmental assessment and finding of no significant impact relative to USDA funding of research on transgenic carp. Federal Register 55, 48661-48662.
Valenzuela. P., Medina A., Rutter. W.J., Ammerer, G. & Hall, B.D. (1982) Synthesis and assembly of hepatitis B virus surface-autigen particles in yeast. Nature, 298, 347-350.
Vize, P.D., Michalska A.E., Ashman, R., Lyody, B., Stone, B.A:, Quinn, P., Wells, J.R.F. & Seamark, R.F. (1988) Introduction of a porcine growth hormone fusion gene into transgenic pigs promotes growth. J. Cell. Sci., 90, 285-300
WHO (1989) Report of WHO Consultants on Requirements and Criteria for Field Trials on Oral Rabies Vaccination for Dogs and Wild Carnivores. WHO/Rab. Res./89.32.
WHO (1991) Strategies for Assessing the Safety of Foods Produced by Biotechnology. FAO/ WHO, Geneva.
Wright, G., Carver, A., Cottom, D., Reeves, D., Scott, A., Simons, P., Wilmut, Garner, I. & Colman, A. (1991) High level expression of active human α1-antitrypsin in the milk. Bio/Technology, 9, 830-834.
Xie, Y.F., Liu, D., Zou, J., Li, G.H. & Zhu, Z. Y. (1993) Gene-transfer via electroporation in fish. Aquaculture, 111, 207-213
Young, F.E. & Miller, H.I. (1989) “Deliberate releases” in Europe: over-regulation may be the biggest threat of all. Gene, 75, 1-2.
Yu, S.-F., von Rüden, T., Kantoff, P.W., Garber, C., Seiberg, M., Rüther, U., Anderson, W.F., Wagner, E.F. & Gilboa, E. (1986) Self-inactivating retroviral vectors designed for the transfer of whole genes into mammalian cells. Proc. Natl. Acad. Sci. USA. 83, 3194-3198.
Zhang, P., Hayat, M., Joyce, C., Gonzalez-Villagenor, L.T., Lin, C.M., Durham R.A., Chen, T.T. & Powers, D.A. (1990) Gene transfer, expression and inheritance of pRSV-rainbow trout GH cDNA in the common carp Cyprinus carpio (Linnaeus). Mol. Reprod. Dev., 25, 3-13.