Robert K. Bush and Susan L. Hefle
Williams S. Middleton V.A. Hospital and Department of Medicine and Food Research
Institute, University of Wisconsin, Madison, Wisconsin; Food Allergy Research
and Resource Program, University of Nebraska, Lincoln, Nebraska
I. 序論
この論説では、一般的なアレルゲン性食物と、希なアレルゲン性食物、加えて同定されたアレルゲン性タンパク質の生化学を概論する。種々の食品とアレルゲン性タンパク質のアレルゲン性を立証する技術(手法)が活用されている。しばしば、特にアナフィラキシー症状を伴う場合、経口誘発は行われていなかった。むしろ、問題のアレルゲン性物質は、皮膚テストの陽性結果か、特異的イムノグロブリン(IgE)抗体を用いたin vitro アッセイの証明に基づいた推論の上でアレルギーに関係しているとされてきた。
A. アレルゲン命名法
遺伝子組換え技術の急進展に応じて、アレルゲン命名法体系が採用された。この体系は最近Kingらにより詳細が述べられた1。アレルゲンはその基原の分類学的名称に基づいて示される。(分類学上の)属の最初の3文字が使われ、更に(分類学上の)種の最初の文字とアラビア数字が使われる。この数字はアレルゲンの同定された順序によってアレルゲンに割り当てられ、通常同じ文字は近接の種の相同のアレルゲンに用いられる。例えば、ブラウンシュリンプ(Penaeus
aztecus)に関して記述された最初のアレルゲンはPen a 1と示され、ショウナンエビ(Penaeus indicus)から得られる相同的なタンパク質はPen
i 1と示される。
67%以上のアミノ酸配列相同性を持つアレルゲングループは、イソアレルゲンと呼ばれる。イソアレルゲン各々は、変異型と呼ばれる近似した配列からなる多様な形態を持つ。この命名法体系は、アミノ酸配列か糖修飾の程度が互いにわずかに異なる多形的形態の記述を可能にする。その上、この命名法体系はアレルゲン遺伝子、メッセンジャーRNA(mRNA)、cDNA、更にアレルゲン性に関与した遺伝子組換え体や合成ペプチドの記述規則も定めている1。この命名法体系で、いくつかの主要な食物アレルゲンを示した例を表1に示した。
表1 同定された主要食物アレルゲン
|
アレルゲン供給源 |
アレルゲン |
分子量 |
配列データa |
参考文献b |
| Arachis hypogea (ピーナッツ) |
Ara h 1 |
63.5 |
C |
138 |
| Bertholletia excelsa (ブラジルナッツ) |
Ber e 1 ; 2S アルブミン |
12 |
C |
194 |
| Brassica juncea (オリエンタルマスタード) |
Bra j 1 ; 2S アルブミン |
14 |
C |
349 |
| Gadus callarias (タラ) |
Gad c 1 ; アレルゲン M |
12 |
C |
69 |
| Gallus domesticus (ニワトリ――卵) |
Gal d 1 ; オボムコイド |
28 |
C |
31 |
|
Gal d 2 ; オボアルブミン |
44 |
C |
35 |
|
|
Gal d 3 ; オボトランスフェリン |
78 |
C |
37 |
|
|
Gal d 4 ; リゾチーム |
14 |
C |
42 |
|
| Glycine max (ダイズ) |
Gly m 1 |
34 |
P |
174 |
| Penaeus aztecus (ブラウンシュリンプ) |
Pen a 1 ; トロポミオシン |
36 |
P |
5 |
| Penaeus indicus (ショウナンエビ) |
Pen i 1 ; トロポミオシン |
34 |
P |
92 |
| Metapenaeus enis (ヨシエビ) |
Met e 1; トロポミオシン |
34 |
C |
94 |
| Sinapis alba (イエローマスタード) |
Sin a 1 ; 2S アルブミン |
14 |
C |
268 |
a アミノ酸配列は直接、もしくはcDNA配列からの推測で得られた。
b 参考文献は部分的(P)、もしくは完全な(C)配列が入手可能なものを参照している。
加えて、研究者達は、慣例上アレルゲンを主要なものと、主要でないものとに分類している。主要なアレルゲンは通常、そのアレルギー患者の50%以上がそれに対して特異的に結合するIgEを持っているタンパク質と定義される1,2。主要なアレルゲンの例として、ピーナッツのAra
h 13、卵のオボアルブミン、オボムコイド、オボトランスフェリン4、エビのPen a 1があげられる5。非主要アレルゲンの重要性が討議されている。非主要アレルゲンは、実験上の人為結果であるか、又は、IgE結合できる主要アレルゲンに似た構造を含む可能性があるが、ヒスタミン遊離を誘発するのに必要な高次構造は持たない可能性がある。例えば、ある研究において、ピーナッツアレルギー患者が、他の多くのマメ科植物のタンパク質と結合するIgEを産生し、結果として皮膚テストとRASTで陽性であったことが示されている。しかしながら、この様な交叉反応性の臨床症状は希であり、その患者達はピーナッツと、おそらく他の1種のマメ科の食物とアレルギー性を示したにすぎない6。一方、アレルゲンをサブユニットまで分離し、同定できる方法において、非主要アレルゲンは、実際にはより大きな主要アレルゲンの一部分であることが判明した。それ故、非主要アレルゲンは各個人にて重大な反応が起こる可能性を持っている。
主要アレルゲンは、しばしば食物中に大量に含まれることがある。Ara h 1はピーナッツ貯蔵タンパク質の一部分である7。しかしながら、このことは通常のケースとは限らない。例えば主要タラアレルゲンのGad
c 1はタラの総タンパク質の小画分を構成するけれども、やはり主要アレルゲンである8。
II. 一般的な動物由来のアレルゲン性食物
A. 牛乳
世界中で多くの人間が多量の牛乳(Bostaurus)を消費している。牛乳により仲介されたIgE感受性は、最も一般的な食物アレルギーの1つである。世界中の幼児、子供の牛乳アレルギーの全般的な罹患率は、生後3ヶ年において約2.5%と推定される9-11。しばしば、症状は生後3ヶ月以内に始まるが、多くの子供は3歳までに感受性を失う。成人における牛乳アレルギーは尋常でない。このアレルギーはしばしば子供で嘔吐や下痢などの症状により明らかになるが、約1/3〜1/2の子供は、アトピー性皮膚炎(AD)、蕁麻疹、血管浮腫、紅斑性発疹などの皮膚症状を経験している。
牛乳は、多数のタンパク質から構成されている。今までに2つの主要なタンパク質類が確認されている。1つは総タンパク質の80%を占めるカゼイン、もう1つは同20%を占めるホエイタンパク質である。カゼインは、生のスキムミルクを酸処理(pH4.6、20℃)後、沈殿するリンタンパク質であり、一方ホエイタンパク質はカゼイン沈殿後の上清に残存する12。特定の乳タンパク質の命名法には、タンパク質のファミリーを同定するクラス名の先頭に下付け文字付き/下付け文字なしのギリシャ文字を利用する。タンパク質の遺伝的変異型は、クラス名の後に上付き文字付き/上付き文字なしの大文字のアラビア文字で表示する。翻訳後修飾はその順に追記される。多くの乳タンパク質はヘテロジェネアスである12。主要なタンパク質類の特性を表2に示した。
表2
主要牛乳タンパク質
|
タンパク質 |
濃度(g/l) |
総タンパク質に |
分子量(kDa) |
|
カゼイン |
24〜28 |
||
|
α-カゼイン |
15〜19 |
23.6〜25.2 |
|
|
αS1 |
12〜15 |
34 |
|
|
αS2 |
3〜4 |
8 |
|
|
β-カゼイン |
9〜11 |
25 |
23.9 |
|
κ-カゼイン |
3〜4 |
9 |
19 |
|
γ-カゼイン |
1〜2 |
11.5〜20.5 |
|
|
ホエイタンパク質 |
5〜7 |
||
|
β-ラクトグロブリン |
2〜4 |
9 |
18.2 |
|
α-ラクトアルブミン |
1〜1.5 |
4 |
14.1 |
|
プロテオース-ペプトン |
0.6〜1.8 |
4 |
|
|
血液タンパク質 |
|||
|
アルブミン |
0.1〜0.4 |
1 |
67 |
|
イムノグロブリン |
0.6〜1.0 |
2 |
160〜200 |
Yunginger199を変更
1. 主要アレルゲン
多くの乳タンパク質が、ヒトに対してアレルギー性や免疫性を示すことが確認されてきた。多くの患者が、複数の乳タンパク質に対してアレルギー性を示すことが、皮膚テスト反応性や経口テストにより確認される。しばしば、牛乳に対してアレルギー性を示す人達は、ヤギや羊の乳に対するIgE抗体を血清中に持っていることが知られている13,14。カゼインやβ-ラクトグロブリンは、牛乳中の主要なアレルゲンである10,14,15。牛乳のタンパク質もしくはタンパク質ファミリーにアレルギー性を示す人々の割合は、反応を定義する方法により変動する。経口テストによると、β-ラクトグロブリンは同量のカゼインよりも強い反応性を示す14,16。皮膚テストを実施した時、カゼイン(63%)はβ-ラクトグロブリン(62%)より、わずかに優勢であった10。採用した方法により他よりも反応性に富むタンパク質の一群が個々の研究において散見されるが、一般的な見解では牛乳に対するアレルギー反応の主原因はカゼインとβ-ラクトグロブリンである。
カゼイン
カゼインは化学的に類縁のタンパク質ファミリーである。個々のカゼインタンパク質への反応性の頻度は、体系的に評価されたことが無い。α-s1-カゼインは少なくとも5つの遺伝的変異体を持つ。α-s1-カゼインはマウスに対する連続型エピトープを持った分子量23kDaのリン酸タンパク質である17。α-s1-カゼインのアミノ酸配列は解読されている12,18。α-へリックスセグメントにより結合した疎水性、親水性ドメインの構造が、明らかになっている12。α-s2-カゼインの翻訳後リン酸化の程度は多様である。4つの遺伝的変異体が同定されている12。β-カゼインは、7つの遺伝的変異体を持つ1つの主要コンポーネントと、主要コンポーネントのタンパク質分解フラグメントである8つの非主要コンポーネントから成っている。β-カゼインの主要コンポーネントの分子量は23,980である12,
18。モデル研究によると、β-カゼインはC末に分散した疎水性な側鎖と、親水性のN末を伴った中央表面構造を持っている。κ-カゼインは、2つの遺伝的変異体から成る。κ-カゼインは、105〜106番目のアミノ酸の間でレニン(キモシン)により2つのドメインに分解される。この疎水性ドメイン(パラ-κ-カゼイン)は可溶性でないが、極性のあるドメイン(マクロペプチド)は非常に可溶性である12。
β -ラクトグロブリン
ホエイタンパク質は、乳タンパク質の約20%を構成する。ホエイタンパク質の多くはβ-ラクトグロブリンであり、それはリポカリンファミリーに属する分子量18kDaのタンパク質である。β-ラクトグロブリンには、少なくとも6つの遺伝的変異体がある。β-ラクトグロブリンの一次構造は解読されている12,18。β-ラクトグロブリンの全てのDNA配列が報告されており、羊のβ-ラクトグロブリンと91%相同性があると示されている19。
2. 非主要アレルゲン
多少ながら、ホエイタンパク質のα-ラクトアルブミンとウシ血清アルブミン(BSA)とも、牛乳アレルギーに関連している16。
α -ラクトアルブミン
α-ラクトアルブミンは、2つの遺伝的変異体から成り、その分子量は約14 kDaである。α-ラクトアルブミンはクローン化され、そして塩基配列が解読されている20。アミノ酸の一次構造が決定されている12,18。2つの遺伝的変異体はわずか1アミノ酸配列しか違わない。シークエンス解析によると、リゾチームとの相同性が認められた。明らかにこのタンパク質は、グルコースをラクトース(主要な牛乳の糖)に変換するガラクトースの転位を促進する。有意な数の牛乳アレルギー患者において、α-ラクトアルブミンは皮膚テスト、経口テストで陽性を示す14。
BSA
BSAは、乳中に検出され、そしてウシ血清アルブミンと同じ特性を示す。一部の牛乳アレルギー患者において、BSAは皮膚テストと経口テストともに陽性を示す16。BSAは、乳タンパク質の約1%を占める、分子量67kDaのヘテロジェネアスなタンパク質である。
その他のタンパク質
他の乳成分は時々アレルゲン性を示す。これらは、全乳タンパク質の2%以内からなるイムノグロブリン(Ig)、β2-マイクログロブリン、トランスフェリン、ラクトフェリン14、オキシダーゼ、アルカリフォスファターゼ、およびカタラーゼである21。メイラード反応生成物(ラクトース・タンパク質結合物)は、時々アレルゲンとして作用するかもしれない。ある研究で、β-ラクトグロブリン・ラクトース結合体が、ネイティブなβ-ラクトグロブリンより皮内皮膚テストで10〜100倍の効力を示した14。
3. 構造−エピトープ
カゼインは重要なアレルゲンであるが、それらがヒトのT細胞またはB細胞に関与できるとのデータは無い。α-s1-カゼインでは、マウスT細胞、B細胞エピトープが連続型エピトープであると確認された17。α-s1-カゼインが臨床アレルギー症状を伴う幼児と小児からのIgEと最も作用しやすいカゼインのサブユニットであるため15、人体におけるα-s1-カゼインのエピトープを注視することは有益と思われる。Baldo21は、IgEブロッティング研究において、κ-カゼインから得られるグリコマクロペプチド(アミノ酸残基106〜167)と、アミノ酸残基99〜167を包含するポリペプチドフラグメントがほとんどの血清と反応することを発見した;後者のペプチドはさらに反応性が高いことが明らかになり、アミノ酸配列99〜105の内にIgEエピトープが存在するかもしれない可能性が示された。
4. 用量反応性
感作(IgE抗体産生)や臨床症状の誘導に必要な乳タンパク質の正確な量は知られていない。加工食品中の微量な乳タンパク質は、敏感な人に対して症状を誘導するかもしれない22。一部の乳児は、母乳保育にもかかわらず、牛乳アレルギーになるかもしれない。母乳中のβ-ラクトグロブリンのレベルはベースレベル、0.0〜3.5μg/l(少なくとも24時間牛乳摂取を禁止した後)から、400mlの牛乳を摂取後の0.01〜2.34μg/lまで上昇する23。これは、ある状況における感作源を説明するかもしれない。β-ラクトグロブリンが全てのサンプルにおいて検出されるとは限らないので、それは唯一の説明でないかもしれない。BSAのような完全なタンパク質も、これらタンパク質を摂取したヒトの末梢血中で検出された24。
B. 卵
ニワトリ(Gallus domesticus )の卵は、広く人間により消費されている。米国、欧州の子供に起こる即時型食物アレルギー反応の内、最も頻繁に起こる一つに、卵アレルギーがある25。しばしば、卵感受性は4〜5歳、遅くとも10歳までに消失するが、1/3の人は6歳以上で臨床上の感受性が持続する25。様々な鳥のタンパク質間に広い交叉反応が認められるが、ニワトリの卵はアヒルの卵よりわずかにアレルギー性が高い26。卵白(アルブミン)は卵黄よりアレルギー性が高い。卵白タンパク質は広く研究されており、ほとんどが精製されアミノ酸配列も解読されている。
卵は56〜61%の卵白と、27〜32%の卵黄から成っている。卵白は約87〜89%の水分と9〜11%のタンパク質から成り、一方卵黄は50%の水分と32〜35%の脂質および16%のタンパク質を含んでいる27。卵白中の主なタンパク質はオボアルブミンで、タンパク質の54%を占めている。卵白中のその他の主なタンパク質は、オボトランスフェリン(12%)、オボムコイド(11%)、オボムチン(3.5%)、およびリゾチーム(3.4%)である。これらのタンパク質に加えて、様々なタンパク質の存在が明らかになっている。オボムチンは2つのサブユニット(180、400kDa)から成る複合糖タンパク質である。オボインヒビターは分子量44kDaのタンパク質であり、アミノ酸配列が明らかにされており、cDNAクローニングにより遺伝子配列も得られている28。オボフラボプロテインは、卵白、卵黄両者に認められ、そしてリボフラビン結合タンパク質として知られている。アビジンは、卵白タンパク質の0.5%を構成している。このタンパク質は分子量66〜69kDaからなるヘテロジェネアスな糖タンパク質の四量体であり、ビオチン結合タンパク質として働いている。その他のタンパク質として、オボマクログロブリン、G2、G3グロブリン(よく特徴が分かっていない)、およびシスタチン、システインプロテアーゼインヒビターが知られている。卵白タンパク質の特徴を表3に要約した。
卵黄は、超遠心分離法により2画分に分離される。沈降画分は微粒画分と呼ばれ、60%のタンパク質と35%の脂質を含んでいる。他方の画分、透明な上清の溶液は血漿(プラズマ)画分と呼ばれ、18%のタンパク質と80%の脂質を含んでいる27。顆粒画分にはリポビテリン(高密度リポタンパク質)、ホスビチンおよび低密度リポタンパク質が含まれる。この卵黄中の低密度リポタンパク質の分子量は、3〜10×106Daと、卵白中の低密度リポタンパク質(160〜190kDa)に比べはるかに大きい。ホスビチンは全卵黄タンパク質中の16%を構成し、鉄キャリア分子である29,30。卵黄タンパク質の特徴を表4に要約した。
1. 主要アレルゲン
オボムコイド
オボムコイド(Gal d 1)は分子量28kDaの糖タンパク質であり、そのpIは4.1であり、トリプシンインヒビター活性を示す。このオボムコイドは、ほかの卵白タンパク質には認められるトリプトファンを含まない。オボムコイドのアミノ酸数は186である31。3つの縦列ドメインがあり、各々膵臓分泌トリプシンインヒビターと相同性があり、また夫々ネイティブな球状タンパク質としてふるまっている。予測による二次構造は、いくつかのα-へリックス構造とβ-構造であり、タンパク質の多形性が存在する。同じくオボムコイドも、いくつかの研究により、主要なアレルゲンであると証明された。例えば1つの研究において、卵感受性患者の血清サンプル68中48検体が放射免疫電気泳動法(CRIE)でオボムコイドと陽性交叉し32、一方同様な研究において、卵感受性患者の血清サンプル34中21検体がRAST(radioallergosorbent
test:放射性アレルゲン吸着試験)陽性かつ、CRIEにてオボムコイドと陽性交叉した33。しかしながら、Bernhisel-Broadbentら34は、商業的に精製されたオボアルブミンを用いて主要な卵アレルゲンとして間違った概念が導かれたことを示した(何故ならば、オボムコイドに1%未満の商業用オボアルブミン標品が混入していたことが明らかになったため)。この研究において、卵アレルギーを持つ18人の子供による皮膚テスト(ST)とRASTとの結果により、オボムコイドが精製されたオボアルブミンより強力なアレルゲンであることが明らかとなった。
表3 卵白タンパク質の特徴
|
タンパク質 |
総タンパク質に |
分子量(kDa) |
pI |
糖質部分 |
|
アレルゲン |
||||
|
オボアルブミン |
54 |
45 |
4.5 |
Y |
|
オボトランスフェリン |
12〜13 |
77.7 |
6.0 |
Y |
|
オボムコイド |
11 |
28 |
4.1 |
Y |
|
オボムチン |
1.5〜3.5 |
0.23〜8.3×106 |
4.5〜5.0 |
Y |
|
リゾチーム |
3.4〜3.5 |
14.3 |
10.7 |
N |
| アレルゲン性未確認 | ||||
|
G2グロブリン |
4.0 |
49 |
5.5 |
Y |
|
G3グロブリン |
4.0 |
49 |
5.8 |
Y |
|
オボインヒビター |
0.1〜1.5 |
49 |
5.1 |
Y |
|
オボグリコプロテイン |
0.5〜1.0 |
24.4 |
||
|
オボフラボプロテイン |
0.8 |
32 |
4.0 |
Y |
|
オボマクログロブリン |
0.5 |
0.76〜0.9×106 |
4.5〜4.7 |
Y |
|
シスタチン |
0.05 |
12.7 |
5.1 |
N |
|
アビジン |
0.05 |
68.3 |
10 |
Y |
Li-Chan、Naka51より変更
表4 卵黄主要タンパク質の特徴
|
総タンパク質に占める割合 |
|||
| タンパク質 |
顆粒 |
血漿 |
分子量(kDa) |
| 顆粒 | |||
|
リポビラリン |
70 |
400 |
|
|
ホスビチン |
16 |
160〜190 |
|
|
低密度リポタンパク質 |
12 |
− |
|
| 血漿 | |||
|
低密度リポタンパク質 |
64 |
3〜10×106 |
|
|
リベチン |
14 |
45〜150 |
|
Yunginger199より変更
オボアルブミン
オボアブルミン(Gal d 2)はpI4.5、分子量43〜45kDaである、リン酸糖タンパク質の単量体である。385個のアミノ酸配列が解読されている35。精製したオボアルブミンは3つの変異体を持ち、それらはA1、A2およびA3と呼ばれ、それぞれ1分子ごとに2、1、および0個のリン酸基を持っている。リン酸化の程度が低い程、変性に対する感受性が強まる。オボアルブミンのmRNA塩基配列が報告されている36。
いくつかの研究によりオボアルブミンが主要なアレルゲンであることが証明されている。例えば、ある研究において、卵感受性患者68人中68人の血清がオボアルブミンに対してCRIEにて陽性を示し32、一方類似の研究において33、34人中34人の血清がオボアルブミンに対してRASTおよびCRIEにて陽性を示した。
オボトランスフェリン(コンアルブミン)
オボトランスフェリン(Gal d 3)の分子量は77kDa、pIは6.0である。オボトランスフェリンの686個のアミノ酸配列は直接解読され37、さらに間接的にmRNA塩基配列からも推定された38。オボトランスフェリンは抗菌活性と鉄結合能を持っている。オボトランスフェリンもいくつかの研究において主要な卵アレルゲンとして認められている。例えば、ある研究では、卵感受性患者の血清68中35検体がオボトランスフェリンに対してCRIE陽性となり32、一方類似の研究では卵アレルギー患者の血清34中20検体が、オボトランスフェリンに対してRAST、CRIE陽性を示した33。
アポビテリン(Apovitellins)
卵黄の低密度リポタンパク質画分から得られるアポタンパク質は、一部の卵感受性患者にとっては主要なアレルゲンである。アポビテリンIは卵感受性患者の血清を利用したRAST研究において、主要なアレルゲンであることが示されている39,
40。アポビテリンVIは、Walshら40のRAST研究において、主要なアレルゲンであることが明らかにされた。Anetら39はアポビテリンIII、V、および
VIが、彼らの研究に協力した人々においては非主要アレルゲンであることを発見した。
2. 非主要アレルゲン
リゾチーム
リゾチーム(Gal d 4)はpI10.7で分子量14.3kDaのタンパク質である。129個のアミノ酸配列が解読されている41。リゾチームは4つのSS結合によりクロスリンクされた一本鎖ポリペプチドである。
この一本鎖はN末から最初の40残基がコンパクトな球状ドメインを形成するよう自ら折りたたまれている42。分解活性部位の一部分を形成する第二の親水性ドメイン(アミノ酸配列40〜85)がある。リゾチームのmRNAはエクソンと隣接したイントロンとともに同定されている43。卵アレルギーにおけるリゾチームの役割は、明確でない。MillerとCampbell44は、ST(皮膚テスト)によりリゾチームが主要なアレルゲンであることを見出していたが、Langeland32は卵アレルギー患者の血清68検体いずれもリゾチームとCRIEにおいて陰性であることを明らかにした。Anetら39は、卵感受性患者の血清9中4検体がリゾチームとRASTにて陽性であったことを明らかにした。
オボムチン
Walshら40は卵アレルギー被験者の血清を利用したRAST研究でオボムチンが非主要アレルゲンであることを明らかにした。
3. 構造ーエピトープ
ホスビチン
Walshら40は卵アレルギー被験者の血清を利用したRAST分析により、ホスビチンも非主要アレルゲンであると結論した。
オボアルブミンのT細胞、B細胞エピトープを決定する際、いくつかの進歩が得られた。Shinodaら45は、卵タンパク質に感受性を持つアトピー性皮膚炎の子供でのT細胞増殖応答を調査した。この増殖細胞集団は、CD4+
CD45 RA+ T細胞と思われた。この増殖応答の原因であるエピトープは調査されなかった。しかしながら、オボアルブミンから調製された合成ペプチドにより、ヒトIgE抗体によって認識される配列がウサギのT細胞を刺激することが明らかにされた46。そのペプチドはアミノ酸配列323〜339から成る。Renzら47は、呼吸経路経由で暴露されたBalb/cマウスにおける即時的アレルギーの発生において、これと同じ配列の重要性を明らかにした。オボアルブミン反応性のT細胞クローンは確立された48。これらの細胞株はインターロイキン4
(IL-4)を分泌するCD4+細胞株のように思われ、これらの細胞がT-helper 2 cell type (TH2)であると思われた。
オボアブルブミンのB細胞エピトープは、更に明確に解明された。Johnsen とElsayed46は、IgEが、アミノ酸配列323〜339のペプチドと結合すると論証した。Kahlertら49は、商業的なオボアルブミン標品のBrCN分解により、IgEが配列41〜172および301〜385のペプチドと結合すると論証した。オボトランスフェリン(Gal
d 3)の研究から得られたデータは、7つの連続したエピトープを示している50。オボムコイドは顕著な糖質を含んだドメインを持っている51。糖質部分がIgE結合エピトープとして作用するか疑わしいが、IgEはグリコシル化されていないドメインでなくグリコシル化されたドメインと結合する52。リゾチームIgG結合エピトープは研究されており、3つの不連続性エピトープが確認されている53(表5)。リゾチームとウシラクトアルブミンとが、約43%の配列同一性を持っていることは注目すべきことである52。
卵白タンパク質と卵黄アポビテリンIIのDNA配列における相同性が報告されている54。卵黄と卵白が、いくつかのIgEエピトープの相同性を持つ可能性がある。面白いことに、Anetら39は、RAST阻害研究において、卵黄と卵白との間でいくつかの交叉を見出している。
免疫応答を誘発するために必要な卵タンパク質の量に関しては、あまり知られていない。オボアルブミンは、容易に分解されない。おそらく、抗原抗体複合体を保持している濾胞性樹状細胞により、持続して体内でメモリーB細胞を刺激するかもしれないと仮定されるが34、この理論は証明されていない。
表5
リゾチームの3不連続エピトープのアミノ酸配列
|
エピトープD1.3 |
||
|
アミノ酸残基 |
18〜27 |
D-N-Y-R-G-Y-S-L-G-N |
|
116〜129 |
K-G-T-D-V-Q-a-w-l-r-g-c-r-L |
|
|
エピトープHEL-5 |
||
|
アミノ酸残基 |
41〜53 |
Q-a-T-N-R-T-D-G-s-t-d-Y |
|
67〜70 |
G-R-T-P |
|
|
84 |
L |
|
|
エピトープHEL-10 |
||
|
アミノ酸残基 |
15〜21 |
H-G-l-d-n-Y-R |
|
63 |
W |
|
|
73〜75 |
R-w-L |
|
|
89〜102 |
T-a-s-v-N-c-a-K-K-l-v-S-D-G |
注記:小文字で示したアミノ酸残基は抗体結合サイトと接触しない
Daviesら53から変更
C. 魚
魚の消費や(魚を)調理した時発生する蒸気を吸入することは、IgE仲介反応の原因となる。
特定の魚種に対するIgE仲介反応の罹患率に関する報告は無く、多くの研究において、タラ若しくは一般的に「魚」のみに言及している。しかしながら、魚は、最もアレルギーに関係する食物の1つであり、致命的なアナフィラキシー反応の原因とみなされている55。魚アレルギーの真なる罹患率は知られていないが、魚過敏症の発症は魚の消費が平均以上の国々で多い。例えば、タラアレルギーは、スカンジナビア諸国において最も一般的な食物アレルギーである可能性がある56。
多くの食用魚は硬骨魚類に属している。この類に属していないサメは軟骨魚類である(サメ科)。米国で最も消費される魚はわずかな魚種にしか属さず、それらはイワシ科(サケ、マス、白マス、スメルト、カワカマス、ニシン、イワシ、アンチョビー、シャド、ニシンおよびエールワイフ)、パーチ科(バス、パーチ、シイラ、フエダイ、グルーパー、オレンジラッフィー、ベニマス、カサゴ、サバ、メカジキ、およびマグロ)、タラ科(タラ、ポラク、ハッドク、およびヘイク)、カレイ科(ヒラメ、オヒョウ、およびシタビラメ)およびコイ科(コイ、およびナマズ)である57。
1. 主要アレルゲン
Gad c 1
食物アレルゲンの最も広範囲な分析は、Aas とElsayedおよび同僚らにより行われ、その研究の成果は主要なタラアレルゲン(Gad c 1:従来のアレルゲンM)の精製と分類であった。Gad
c 1は、主要なタラアレルゲンでありパルブアルブミンと知られている筋組織タンパク質に属する8ことが、いくつかの研究により実証されてきた58-60。パルブアルブミンは、細胞内外のカルシウム流動をコントロールし、唯一両生類と魚類の筋肉において見出されている。異なった魚種にて構造的に関係するパルブアルブミンの存在は、魚アレルギーの人々の交叉反応を説明すると思われる。何故ならば、Gad
c 1はヘイク、コイ、カワカマスおよびコダラの類似タンパク質と34%の相同性を持つためである8。新鮮なシロタラ筋組織中のGad
c 1の割合は、0.05%〜0.1%である。
2. 非主要アレルゲン
Ag-17-cod
CRIE研究は、Gad c 1と異なった非主要タラアレルゲンの存在を示しているが58,61、それらの特性は明らかでない。これら非主要アレルゲンの1つはAg-17-codと称され、タラアレルギー被験者の血清中8中2検体が、このアレルゲンとIgE結合することが証明された58。タラアレルギーの人々の約10%がタラ血清に見られるある特定のタンパク質と反応するとも報告されたが、そのタンパク質のみに反応する人はいなかった62。
硫酸プロタミン
ヘパリン拮抗剤として広く使われている低分子量タンパク質は、サケおよびサケ科とニシン科(ニシン、イワシ、マス)に属した同類魚種の精子のタンパク質である63。ある研究は魚アレルギー患者の血清中に抗硫酸プロタミンIgEが存在することを明らかにした。この被験者は硫酸プロタミンに対する皮膚テストにも陽性を示した64。しかしながら別の研究では、2人の魚アレルギー被験者において、サケと硫酸プロタミン間でIgE交叉反応が認められなかった65。いくつかの魚過敏症者に関する報告において硫酸プロタミンがアレルゲンであると認められたが66、ある研究では16人の魚アレルギー被験者への硫酸プロタミン投与によって、何ら有害な反応が起こらなかったことが示された67。従って、硫酸プロタミンはめったに過敏症を持った人々に対してアレルゲン性を示さないと結論できた。
すり身63kDaタンパク質
Mataらは68、SDS-PAGEですり身より63.5kDaの単一バンドを得た(すり身:1種もしくは数種類の小魚をミンスし、充分に洗浄したもの)。RASTを用い、彼らは魚アレルギー患者の血清6中6検体が、すり身に対してわずかな陽性反応を示したが、皮膚プリックテストでは6人中2人しか陽性を示さなかったことを示した。更に多くの研究が終了するまで、このアレルゲンの重要性に関して結論に達することはない。
3. 構造−エピトープ
a. Gad c 1
Gad c 1は分子量12,328Daの酸性タンパク質(pI 4.75)であり、113個のアミノ酸と1つのグルコース分子から成る69。パルブアルブミンの様に、Gad
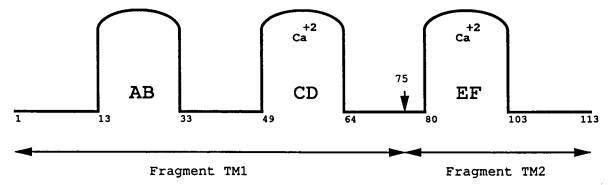
c 1の3次構造は3つのドメイン(AB、CDおよびEF)から成っている。CD、EFドメインは、それぞれ1つのカルシウムイオンサイトを配置しているが、ABドメインには、この特性が無い(図1)。

| 図1 | Gad c 1分子。カルシウムはループCDとループEFに結合しているのに対し、ループABはこの特性を欠いている。フラグメントTM1は1〜75番目のアミノ酸配列を持つ; フラグメントTM2は76〜113番目のアミノ酸配列を持つ。(Elsayed、Apold70より変更) |
Gad c 1は、少なくとも5つのIgE結合サイトを含んでいる70。Gad c 1の75番目のアルギニンは、3次構造において主要な役割を果たしているが、このアルギニンを修飾してもIgE反応性は変化しない71。このアルギニン残基をトリプシンで分解すると、2つのアレルゲン性フラグメントが生じ(TM1とTM2)、これらは同様に皮膚プリックテスト、Prausnitz
Kustner(受動感作)テストおよびRAST阻害研究において活性を示した72。TM1は1〜75番目のアミノ酸から成り、AB、CDドメインを含んでいる。酸性な59〜62番目のアミノ酸はCDドメインのカルシウムイオンと結合している8。Gad
c 1に存在する1つのグルコース分子は、18番目のシステインに位置している73。糖質を除いたTM1のアレルギー活性が、TM2と同じだったため、この糖質部分はアレルギー活性に関係していないらしい72。フラグメントTM2は76〜113番目のアミノ酸から成り、EFドメインを含み、90〜101番目のアミノ酸はEFドメインのカルシウムイオン結合部分を構成している74。フラグメントTM2もトリプトファン残基1つを含むが、これはアレルゲン性とは関係ないように思われる75。更に、TM1のトリプシン加水分解物は、皮膚テストとPrausnitz-Kustnerテストにおいて33〜44番目のアミノ酸がアレルゲン性を持つために重要であることを示した76。TM2のトリプシン加水分解研究において、88〜96番目のアミノ酸領域は、部分的にアレルゲン性の原因であることを示した77。
合成ペプチドを用いた研究は、49〜64番目のアミノ酸領域が2つの反復配列(Asp-Glu-Asp-Lys とAsp-Glu-Leu-Lys)をとっていると証明した。49〜64番目のアミノ酸領域がGad
c 1(68%)と比べ、比較的高いRAST抑制(39%)を示し、かつPrausnitz-Kustnerテストで陽性を示すため、これら2つのテトラペプチドは互いに抗体結合にとって重要と思われる。57〜64番目のアミノ酸領域はアレルギー活性を示さなかった78。次の論文によると、41〜64番目のアミノ酸領域に3つの相同的なテトラペプチドが含まれており、24アミノ酸の断片中、6アミノ酸の間を空けて3つのサイトが繰り返されていることが示された。この領域の一連の合成ペプチドは、全てのペプチドはRAST阻害とPrausnitz-Kustnerテストで陽性を示す最小限の2つのテトラペプチドを含むので、少なくとも2つのテトラペプチドが抗体との反応に必要であることを示した79。IgE結合能力は、(抗原認識部位間の)アミノ酸の立体構造と配列ともに依存しない。
合成ペプチド研究は、EFドメインの88〜103番目のアミノ酸がCDドメインと37.5%のアミノ酸配列の相同性があることも示したが、最終的に41〜64番目のアミノ酸領域の抗体結合の原因となるテトラペプチドを位置付ける主要部位を欠落している。しかしながら、この残基はin
vivo (Prausnitz-Kustnerテスト)とin vitro (RAST阻害テスト)両方のテストで、IgEと特異的に結合した80。従って、88〜103番目のアミノ酸領域は阻害可能だが、アレルギー反応を誘導できない一価の結合能を有していると思われる。
ABドメインはカルシウムと結合しないが、それでもCD、EFドメインと30%を超えるアミノ酸配列相同性を有し、13〜32番目のアミノ酸から成っている。この領域の合成ペプチドは、ABドメインがPrausnitz-KustnerとRAST阻害分析にて、2価で機能していることを示している。それは、RAST阻害においてGad
c 1と比較して6:1の比率において等モル濃度にて反応する81。
13〜32番目のアミノ酸領域および49〜64番目のアミノ酸領域は、アレルギー反応を誘導する2価の決定因子を有している。Gad c 1の中では、アミノ酸配列の繰り返しが豊富である8。35〜41番目のアミノ酸領域と67〜73番目のアミノ酸領域は、7アミノ酸のうち5アミノ酸が一致しており(Leu-X-Ala-Phe-X-Ala-Asp)、これがIgE結合サイトの連続と思われる。65〜83番目のアミノ酸領域が、CD、EGドメイン間に見出された。同様な部分がABドメインとCDドメインとを結合させ、33〜44番目のアミノ酸領域を含んでいる。これら2つの部分は高い相同性を持つ71。このこととTM1、TM2間の高い免疫交叉反応性の全てが、IgE結合サイトがポリペプチド鎖に沿って反復して分布していることを示している。
b. 硫酸プロタミン
サケのプロタミンであるサルミンAIのアミノ酸配列は、
| 10 | 20 | 30 |
| H-P-R-R-R-R-S-S-S-R | -P-V-R-R-R-R-R-P-R-V | -S-R-R-R-R-R-R-G-G-R-R-R-R-OH. |
である63。ニジマスのプロタミンであるイリジン(iridine)IaはサルミンAIと異なり、19番目にアルギニンが追加されている(下線で示した)。
魚アレルギーの人達にアレルギー反応を誘導するにあたる魚の総量に関する情報は充分無いが、タラアレルギー患者が精製したGad c 1 1mg以内を混入した50gのミートボールに反応したと報告されている59。O’Neilら82は二重盲検偽薬コントロール食物試験(DBPCFC)により、ナマズ1g以下、他科の魚(タラ、フエダイ)4g以下が、魚感受性のある人々のアレルギー反応を誘導することを明らかにしている。陽性反応は、未調理段階で2オンス(約56g)の魚を使ったDBPCFCで得られた83。別の研究では、8gの乾燥魚の摂取後一時間以上後に、反応が誘導されたと報告している84。しかしながら、これら最後の2つの研究においては、魚に対するアナフィラキシー症歴をもつ被験者において行われていない。
D. 甲殻類
通常、米国において少なくとも30種の可食性甲殻類が消費されている。小エビ、中型エビ、カニ、ロブスターおよびザリガニを含む甲殻類ファミリー(筋足動物門、甲殻網)は、食物過敏症の一般的な原因である85。罹患率は知られていないが、研究者達は米国において250,000人以上の人が甲殻類に対するアレルギー反応を発症する可能性があると推定している86。魚の様に、定期的に消費量が増す地域にて、甲殻類に対するアレルギーの発症率は高くなると予想される。
1. エビ:主要アレルゲン
a. 抗原Iおよび抗原II
エビは甲殻類アレルゲンで最も研究されている。Hoffmanら87は、エビのアレルゲンに関して部分的に特徴を決定した最初の人々である。2つのアレルゲン性タンパク質が生のエビの身と殻の抽出物から見出され、それらは抗原IおよびIIと称された。11人のエビ感受性被験者の研究において、彼らの血清中11中7検体が抗原Iと結合した。生のエビと殻の抽出物に極微量の抗原Iが見出されるが、それは分子量21kDaの2つの非共有結合ポリペプチド鎖から成る熱に不安定なタンパク質と考えられる。ゲルろ過により精製すると、抗原Iの分子量は45kDaで、二量体であると推定された。抗原IのpIは4.75〜5で、189個のアミノ酸と、0.5%の糖質から成る。抗原II(ボイルしたエビから容易に単離される)は、熱に安定な分子量38kDa、pI5.4〜5.8の糖タンパク質であり、341個のアミノ酸から成り、4%の糖質を含んでいる。11例のエビアレルギー患者血清の全てにおいて抗原IIがIgEと結合したため、抗原IIはこの研究の被験者にとって主要なアレルゲンと思われる。RAST阻害率は、抗原IIと調理済みエビとの間で0.98の相関係数であった。このアレルゲンは皮膚テストで実施されず、2価結合能は評価されなかった。アミノ酸の構成や免疫学的研究により、抗原IとIIとは関連していないと見なされた。
b. SA-I および SA-II
Nagpalら88は、ボイルしたエビから単離した2つのアレルゲン性ポリペプチドについて述べている。アレルゲンSA-Iの分子量は8.2kDaで、それ以上の解析は行われていない。2番目のアレルゲン、SA-IIは301個のアミノ酸から成るり、分子量は34kDaで、Hoffmanらにより単離された抗原Iに似ていると思われるが87、糖質を含まないと報告されている。Nagpalらは、SA-IとSA-IIのアレルゲン性エピトープの54%が相同性を示しており、SA-IはSA-IIの分解物であるかもしれないと述べた。これを考察に取り込むと、ボイルしたエビの粗抽出物の全IgE結合活性に対して、SA-Iは約33%、SA-IIは約56%寄与していることになる。この著者は、残りのIgE結合活性(11%)は、以下で結論されるtRNAアレルゲンに含まれることを示している。これらのアレルゲンは皮膚テストにより評価されなかった。
c. Pen a 1 とPen i 1
Daulら5,89,90は主要なアレルゲン、Pen a 1をボイルしたブラウンシュリンプ(P. aztecus)から単離し、その配列がショウジョウバエのトロポミオシンと類似していると報告している。Pen
a 1は分子量36kDaであり、調理済みエビの煮汁91と肉から容易に単離され、SA-IIに類似している88。Pen
a 1は、調理済みエビの粗抽出物中の可溶性タンパク質の20%を構成し、エビ感受性患者プール血清と全エビ肉抽出物とのRAST反応を75%まで阻害した。このアレルゲンは、エビ感受性個体の血清34中28検体(82%)中のIgEと結合した。
Pen a 1は312個のアミノ酸と2.9%の糖質から成り、pIは5.2である。Pen a 1は、別種のエビ(P. indicus)から単離されたPen
i 1と関連している92。
Pen a 1のエンドプロテアーゼLys-C研究は、21個のアミノ酸から成るペプチドのタンパク質配列と様々な種のトロポミオシンとの著しい相同性(60〜85%)を示し、Pen
a 1がエビのトロポミオシンであるという結論と一致する5。最大の相同性はショウジョウバエトロポミオシンと129〜149番目のアミノ酸の領域で(72〜87%)で生じており、様々な哺乳動物種とでは60〜62%である。ショウジョウバエのトロポミオシンとで見られる高い相同性は、エビと昆虫間の系統的な関係を示すことで解釈できる。21個のアミノ酸から成るペプチドのアミノ酸配列は、V-L-E-N-R-S-L-S-D-E-E-R-M-D-A-L-E-N-Q-L-Kである。
Shantiら92も、Pen i 1のトリプシン分解物の配列がショウジョウバエトロポミオシンと類似しており、エビトロポミオシンから得られた2つのトリプシン処理に由来するペプチドは、エビ特異的IgEと結合したと報告している。これらは50〜66番目のアミノ酸領域と153〜161番目のアミノ酸領域にある:50〜66のアミノ酸配列はM-Q-Q-L-E-N-D-L-D-Q-V-Q-E-S-L-L-Kであり、153〜161はF-L-A-E-E-A-D-R-Kである。50〜66と153〜161両ペプチドともSA-II特異的IgEのエビトロポミオシンとの結合を阻害し、両ペプチドとも100
pmol/mlで阻害が50%に達している。他のトリプシン処理に由来するペプチド(一部分子量2kDa未満)も、より弱い程度のIgE結合阻害であったが、現在のところ、これらのペプチドはマイナーなIgE結合成分であるかもしれない。
種々の脊椎動物から得られるトロポミオシンの対応した領域も、50〜66の領域にて多少の交叉反応性を示したが、153〜161の領域において哺乳動物種のトロポミオシンと著しいアレルゲン性交叉反応性を示した:ニワトリ、ウサギおよびヒトトロポミオシンにて7/9アミノ酸、ラットトロポミオシンにて6/9アミノ酸。ショウジョウバエトロポミオシンは、153〜161番目のアミノ酸領域にてSA-IIと同一であった。多くのトロポミオシンが、155〜161番目のアミノ酸領域にて相同性を持っている。
著者(Shanti95)らは、他のトロポミオシンとエビのトロポミオシン間での153番目(Leu)と154番目(Ala)における相同性の欠落は、おそらくそれらがIgE結合にとって重要であろうことを示している。
エビアレルゲンであるPen a 1、抗原IIおよびSA-IIのアミノ酸組成は類似している(表6)。
更に、このことはこれら3つのアレルゲンが同じタンパク質、エビトロポミオシンであることを示しており、抗原IIとPen a 1は両者とも糖質を含む。
表6
エビアレルゲンPen a 1、抗原II、Sa-IIのアミノ酸組成
|
Pen a 1 |
抗原II |
SA-II |
|
|
分子量 (kDa) |
36 |
38 |
34 |
|
アラニン |
33 |
31 |
21 |
|
アルギニン |
26 |
19 |
30 |
|
アスパラギン酸 |
40 |
58 |
39 |
|
システイン |
ND |
2 |
3 |
|
グルタミン酸 |
80 |
61 |
75 |
|
グリシン |
10 |
20 |
6 |
|
ヒスチジン |
1 |
4 |
3 |
|
イソロイシン |
35 |
30 |
30 |
|
ロイシン |
6 |
12 |
6 |
|
リジン |
26 |
27 |
27 |
|
メチオニン |
8 |
9 |
6 |
|
フェニルアラニン |
4 |
9 |
6 |
|
プロリン |
2 |
6 |
3 |
|
セリン |
14 |
15 |
12 |
|
スレオニン |
12 |
12 |
9 |
|
トリプトファン |
ND |
ND |
4 |
|
チロシン |
4 |
7 |
6 |
|
バリン |
13 |
19 |
15 |
|
計 |
312 |
341 |
301 |
Daulら5より変更
d. Met e 1
Leungら94は、ヨシエビ、Metapenaeus enisのcDNAライブラリーから組換えエビアレルゲンを作製した。281個のアミノ酸をから成るこのアレルゲンは、アミノ酸組成においてPen
a 1 とPen i 1と似ており、SDS-PAGEで分子量が34kDaであった。イムノブロット研究において、この組換えアレルゲンは、この研究でのエビに対するアナフィラキシー反応の病歴を持つ8人全ての血清IgEと結合した。Leungら94は、エビトロポミオシンとして、分子量34kDaのアレルゲンを同定した他の研究グループを確認した。彼らは組換えエビアレルゲンMet
e 1が、Shantiらが示した50〜60番目のアミノ酸領域と同一のIgE結合配列を持つことを見いだし、そしてもう一方の153〜161番目のアミノ酸領域と類似した短いIgE結合配列F-L-A-E-E-A-D-R-Kも見いだした。
2. エビ:非主要アレルゲン
a. 転移RNA
ボイルしたエビ(P. indicus)の非主要アレルゲン性tRNA部分が記述されている95。この「精製された」RNAアレルゲンは、アミノ酸として11%の乾燥重量を有する。酵素処理後、84%のアミノ酸が消失したが、アレルゲン性は残存していた。約1μgのエビRNAは、固相エビRNA RASTで89%の阻害を起こしていた。しかしながら、Nagpalら95は、彼らの研究において1人の患者の血清しか用いないので、正常な臨床的反応性を反映していない可能性があると結論した。RNAは完全にアミノ酸残基を欠いていないため、このアレルゲン性はRNAに結合したタンパク質やペプチドによる可能性がありうる。このRNAアレルゲンは皮膚テストで分析されず、RNAアレルゲンの2価結合能は評価されなかった。このことは依然としてIgE反応の誘導に関係した食物中の核酸について文書化された唯一の例のままである。
b. 用量反応性
Daulら96は、エビ過敏症の30人の被験者の内、全7回の二重盲検試験にて、6人の被験者が陽性に反応したことを見いだした。4件の陽性反応は、エビ4当量の摂取で起こり(エビ1当量は約8mg、言い換えると標準的な4gの中型エビから得られるタンパク質抽出物の量)、そして3件の陽性反応はエビ16当量の摂取により起こった。たった1〜2gのエビで、感受性が高い人々にアナフィラキシー反応を誘発できるようである97。
口咽頭の掻痒や時折自覚される咽頭の腫脹は、陽性他覚症状を誘発する量より少量のエビによる誘発試験で陽性であった人のほとんどと関連がある96。即時的I型エビ過敏症反応と一致する病歴を持った被験者のあるグループでは、アトピー性疾患の患者のみ摂取後のアナフィラキシーが報告され、30人の非アトピー性患者では、唯一の症状として全身性掻痒が報告されている98。
3. カニ
ズワイガニが職業環境におけるアレルギー性感作の原因であることが示されている99,100。熱に不安定および熱に安定なアレルゲンが、ズワイガニ抽出物に見られるが、ズワイガニ特異的IgEは、生よりボイルしたズワイガニの方に良く結合した100。
カニの煮汁と調理済みカニ肉の抽出物をSDS-PAGEにかけると、最も顕著なバンドは37〜42kDaであった。それらSDS-PAGEで分離されたタンパク質のイムノブロットでは、ズワイガニアレルギー患者血清の大部分で、分子量37〜42kDaのバンドへのIgE結合がみられる。ただし放射性免疫染色によって14kDaもしくはその近傍のバンドもみられた(Hefle、Bush、Cartier、Malo、Lehrerの私信)。
4. ロブスター
交叉免疫電気泳動法(CIE)で、明瞭なイセエビの沈降素が患者IgE結合活性によって消失することが、14の甲殻類感受性血清を用いたCRIEにより示された101。13の甲殻類アレルギー患者血清が、これらの沈降素とCRIEにて反応する。4つのIgE結合沈降素を含むイセエビ抽出物;抗原8(10血清に陽性)と抗原13(5血清に陽性)は、主要なアレルゲンであり、最も放射性免疫染色される。抗原3と抗原6は、それぞれ8血清,2血清において弱く放射性免疫染色された。
5. ザリガニ
上述の研究にて、沈降素は甲殻類特異的IgE結合活性に対しても評価された101。6つのザリガニ抗原が、CRIEによる放射性免疫染色にて陽性であった。抗原11は主要アレルギーコンポーネット(9血清で陽性);抗原12(同様に9血清で陽性)も主要アレルゲンの可能性があるが、抗原11の沈降線(arc)の下にあったため、共沈の人為的結果であった可能性がある。抗原6(1血清で陽性)、抗原8(6血清で陽性)、抗原10(2血清で陽性)、そして抗原13(7血清で陽性)は、異なる程度で放射性免疫染色された。
III. 一般的な植物由来のアレルゲン性食物
A. ピーナッツ
ピーナッツはマメ科の一年生植物で、南アメリカ原産である。米国では数種類のピーナッツが栽培されているが、最もよく栽培されているのはバージニア、スペイン、及びサウスイーストランナーの3品種である。バージニア種のピーナッツは粒をそのまま食べたり菓子類に使うのが主な用途である。サウスイーストランナー種は主としてピーナッツ油やピーナッツバターの製造に用いられる102。米国で生産されるピーナッツの大半(63%)はピーナッツバターの製造に使用される103。子供達は幼少の頃からピーナッツを摂取し成分に曝露されているが、通常ピーナッツバターとして摂取している。ピーナッツは人気のある食品ではあるが、同時に最も一般的なアレルギー食品としても知られている。ピーナッツアレルギー反応は突発性で重症であることが多く、子供が成長するにつれて発症しなくなるというのは稀である。
ピーナッツのタンパク質は慣習的にアルブミン(水溶性)とグロブリン(食塩水可溶性)に分類されてきた。貯蔵タンパク質の大半はグロブリンで、全タンパク質の87%を占める104。年々、ピーナッツのタンパク質は更に細かく分画され、アルブミン、アラキン、及びコンアラキン又はノンアラキンに分類されるようになった105-109。グロブリンは2種類の主要なタンパク質アラキン及びコンアラキンより成るが、これらはそれぞれレグミン及びビシリンに相当する。前者は主にα‐アラキン及びα‐コンアラキンとして知られる高分子量グロブリンを成分とする106。
アラキンとコンアラキンは種々のイオン強度及びpHで容易に解離、会合するため、個々の成分を正確に分別するのが難しい110-112。加えて、アラキンとコンアラキンはアミノ酸組成も電気泳動の移動度も似ており、このことから構造が類似していることが示唆される。アラキン、コンアラキンとも中性糖及びアミノ糖を含んだ糖タンパク質である108,113。ピーナッツの分子多型性を免疫化学的分析及び電気泳動による分析で検討した結果では、ピーナッツの品種間で差異があることが判ったが114,115、野生型品種の多くは栽培品種に比べてアラキン含量が遥かに低い。殆ど全ての遺伝型で45
kDaのポリペプチドが見出されているが116、アラキンの36 kDaサブユニットは特定の栽培品種のみに見出される117。
アラキン
自然の状態ではアラキンは少なくとも分子量600 kDaで存在するが、容易に340〜360 kDaの2量体及び約170〜180 kDaの単量体に解離する118,119。アラキンはSDS-PAGE119,120、で測定した分子量が19〜42
kDa、 pIが5.8〜8.3119の範囲に亘る約6個のサブユニットを含んでいる。このグロブリンの炭水化物含量は0.3〜0.6%である108,113,120。
201個のアミノ酸残基から成るアラキンのサブユニットが単離されている121。塩基性アミノ酸がその構造の大部分を占めているが、明瞭な塩基性線状領域は無い。
コンアラキン
JohnsonとNaismith111は、コンアラキンが更に超遠心で2Sと8.4Sの2つの分画に分けられることを示した。その後、これらはそれぞれコンアラキンI及びコンアラキンII(又はα‐コンアラキン)と名づけられた。コンアラキンI(分子量
142 kDa)はピーナッツの総タンパク質の30%近くを占めているが122、詳しい研究は殆どなされていない。コンアラキンIIは分子量が290
kDa109であり、ピーナッツの総タンパク質の15〜25%を占めている122。コンアラキンIIのサブユニットについては6個から8個まで異なる報告がある109,111,123,124。BashaとCherry125はSDS-PAGEを用いて、コンアラキンIIが分子量84、46、34、31、26及び23
kDaの7個のサブユニットに解離することを見出した。ShettyとRao124は64 kDaの主なサブユニット1個と60、32及び21
kDaの少量のサブユニットを認めた。コンアラキンIIは炭水化物を含まず、pIは3.9である124。
1. ピーナッツのアレルゲン
複数のピーナッツアレルゲンが報告されている3,126-132が、いずれも充分な同定や特性の検討はまだされていない。アレルゲン性を有するピーナッツタンパク質の数が多いことが問題の一つであり、研究者の報告によればその数は20を超える126,129,130。Barnettら126は生のピーナッツ及び炒ったピーナッツの粗抽出物中にIgEと結合する16個及び7個のバンドをそれぞれ認めた。Bushら129は2次元PAGEを用いて、生のピーナッツの抽出物中にIgEと結合する11個のタンパク質を見出した。RAST阻害126,127,131及びIgEの酵素結合免疫吸着測定法(ELISA)128を用いた研究から、1種類のタンパク質がピーナッツの全てのアレルゲン性の原因となっているわけではないことが明らかになった。アレルギーに関係するピーナッツの成分はタンパク質又は糖タンパク質である。皮膚テスト及びDBPCFC
(二重盲検偽薬対照食物負荷試験)の研究より、ピーナッツ油にはアレルゲン性がないことが判っている133。
Barnettら126はピーナッツに感受性の患者の血清を用いて、RAST及びCRIE(交叉放射性免疫電気泳動法)で種々のピーナッツ成分のアレルゲン性を検討し、ピーナッツのアレルゲン性はアラキン及びコンアラキン画分の両方に亘って広がっていることを認めた。Taylorら132はアラキン及びコンアラキン画分がアレルゲン性を有することをRAST阻害アッセイで認めた。
HeinerとNeucere134はRAST法を用いて、ピーナッツの子葉、胚軸及びその他の部位の抽出物を含む種々のピーナッツ標品についてアレルゲン性を検討し、子葉、芯(胚軸組織)及び種皮がアレルゲン性を有することを認めた。種皮や芯は加工の際に取り除かれることが多いので、おそらく殆どの人にとっては子葉(仁)が主なアレルゲンであろう。芯はサポニンを含むため苦味があり、種皮はカテコールタンニン及び関連化合物を含んでいて好ましくない色が製品につくため除かれるわけである135。
a. 主要アレルゲン
ピーナッツ-1
Sachsら131は「ピーナッツ-1」と呼称するピーナッツアレルゲンを単離し部分精製した。SDS-PAGE分析によりピーナッツ-1は分子量20及び30
kDaの2個の主なバンドを含むことが判った。これら以外にも数個の微量なバンドがあり、それらの分子量は20及び30 kDaより大きいものも小さいものもあると報告されているが同定はなされていない。薄層等電点電気泳動によれば、ピーナッツ-1のpIは5.25〜5.75であった。著者等は、ピーナッツ-1は異なるサブユニットからなり最も多量に含まれている酸性糖タンパク質の1つであるが、これがピーナッツの唯一のアレルゲン成分ではない、と結論している。
コンカナバリンA反応性糖タンパク質(CARG)
GleesonとJermyn136は生のピーナッツからのCARGの単離を最初に記載している。単離されたタンパク質の分子量は69 kDaであり、炭水化物を12%含んでいる。その後BarnettとHowden127が分子量65
kDaのピーナッツCARGアレルゲンを同定し精製した。RAST阻害試験で得られた結果から、著者等はCARGを主要なアレルゲンの1つとして位置づけた。この実験で、ピーナッツに感受性のある患者の血清サンプルの約50%の頻度でIgEがこのタンパク質に結合したからである。CARGはピーナッツの総タンパク質の約1%を占め136、pIは4.6、炭水化物2.4%を含み、100℃以上及びpH
2.8〜10.0の範囲で安定である。CARGの炭水化物部分を除去するとアレルゲン活性が若干減少するが完全には無くならない127。Meier-Davisら130は炒ったピーナッツの粗抽出物をSDS-PAGE及びイムノブロッティングにかけ、主要アレルゲンと見られる分子量15、20、及び66
kDaの3本のIgE結合バンドを同定したが、これらのバンドについてこれ以上の特徴の検討は行っていない。
Ara h 1
Burksら3はピーナッツに感受性のAD(アトピー性皮膚炎)患者の血清を用いてイムノブロッティング及びELISA法により分子量63.5
kDaの糖タンパク質のピーナッツアレルゲンを同定した。このアレルゲンAra h 1のpIは4.55であった。CARGとAra h 1とは多分同一タンパク質と思われるが、Ara
h 1はコンカナバリンAには結合しない。
Ara h 2
これより後の報告で、Burksら128はもう一つのピーナッツアレルゲンAra h 2を精製し同定している。このタンパク質はSDS-PAGEで分子量が17
kDa、pIは5.2である。上記のピーナッツアレルゲンの物理化学的特性の一覧表を表7に示す。
2. 構造−エピトープ
Ara h 1はクローニングされアミノ酸配列が推定されている137。このタンパク質は複数のIgE結合エピトープを有しており138、また種子貯蔵タンパク質ビシリンと有意な配列相同性を有する7。
表7
単離されたピーナッツアレルゲンの特徴
|
名称 |
分子量(kDa) |
pI |
糖質部分 |
参考文献 |
|
Ara h 1 |
63.5 |
4.55 |
あり |
3 |
|
Ara h 2 |
17 |
5.2 |
あり |
128 |
|
CARG |
65 |
4.6 |
あり |
127 |
|
ピーナッツ-1 |
20 |
5.25〜5.75 |
あり |
131 |
3. 用量反応性
メイヨー・クリニックの研究チームは、ピーナッツによるアナフィラキシーショックで16ヶ月の期間中に4件の死亡があったと報告している55。この報告や他の報告130,140では犠牲者はピーナッツタンパク質を含む食品であることを知らずに食べている。Yungingerら55は、彼等が検討したケースでは摂取したピーナッツの量は多分ミリグラムないしグラムのオーダーであろうと指摘している。DBPCFCによる検討で、50〜100
mgのピーナッツタンパク質が何人かの子供にアレルギー症状を惹起することが示されている141。しかし、アナフィラキシーを惹起する恐れがあるため急性反応に感受性の患者に対する経口投与は行っていない。急速な減感作療法によるピーナッツアレルギー治療の研究においてOppenheimerら142は30〜8
gのピーナッツ(平均約 4 g)を二重盲検で投与してピーナッツ感受性の患者にアレルギー反応が起こるのを認めた。
B. ダイズ
ダイズグロブリンはダイズの主要タンパク質である。食塩水可溶性のダイズタンパク質画分をpH 4.5に調節するとグロブリンが沈殿し、後に乳清(6〜8%のタンパク質を含む)が残る143。この乳清画分はヘマグルチニン、トリプシンインヒビター、及びウレアーゼを含んでおり144、これらの分子の大きさは1S〜6Sである145。
グロブリンは超遠心で2S、7S、11S、及び15S画分に分離するため、これはダイズタンパク質の種々の成分を分類するのに用いられてきた146。これらのタンパク質の研究に用いられる分析法が多岐に亘っているため、Catsimpoolasら147は以下のシステムを提案している。即ちダイズトリプシン・インヒビター以外の2S成分をα-コングリシニンと呼び、RobertとBriggs148によって単離された7S成分をβ-コングリシニン(ビシリン)と呼ぶことにしよう、というものである。グリシニンとβ-コングリシニンがダイズのタンパク質画分の70〜80%を構成している149,150。KoshiyamaとIguchi151の方法で単離した7S成分はγ-コングリシニン、11S成分はグリシニンと呼ばれる。15S成分は主にグリシニンの多量体より成っている152。
α-コングリシニン(2S)
α-コングリシニンはダイズの主要な画分の一つである。2S画分は分子量18.2及び32.6 kDaの熱に安定な成分を有しているが、同時にトリプシンインヒビター及びチトクロムCの活性をも有している144。VaintraubとShutov153は2S画分が2.8Sと2.3Sの2つの成分に分離できることを見出した。2.8S成分はPAGEで36
kDaのバンドとなり、pIは4.4であった。ダイズのトリプシンインヒビター活性はボーマン-バーク型インヒビター(6〜10 kDa)、クニッツ型インヒビター(KSTI、20〜25
kDa)も含め、全て2S画分に含まれていると考えられた154。しかし、後になって、これらの活性はインヒビターがグロブリン単離の際に共沈したことによるものであることが判明した155。
β-コングリシニン(7S)
この糖タンパク質は溶液中、及びおそらく種子の中でも3量体及び/又は6量体として存在する154。単量体の分子量は150〜170 kDa、2量体の分子量は約370
kDaである。pIは4.9と測定されている。β-コングリシニンはα、α’、及びβで表される3つのサブユニットから構成され、サブユニットの組み合わせにより少なくとも7種類の異なる形状(B0〜B6)がある156,157。α及びα’サブユニットの分子量は54
kDaであり、βサブユニットの分子量は42 kDa154である。これら3種類のサブユニットは全て4.5%の炭水化物を含有する156。Satoら158は分子量16及び26
kDaの2種類のサブユニットから成る「塩基性」7Sグロブリン(pI=9.1〜9.3)を記載しており、還元剤非存在下SDS-PAGEで未変性分子は42 kDaのバンドを与える。16及び26
kDaのポリペプチドのpIは各々6.5〜7.0、及び7.7〜7.9であった。Coatesら159は臭化シアン処理後の主要なサブユニットの電気泳動上の挙動を検討した。α’サブユニットは47、19.5及び15.5
kDaの主要なバンドより成っていた。47及び19.5 kDaのバンドは糖タンパク質であった。αサブユニットは54及び19.5 kDaの主要なバンドから成り、共にグリコシル基が付加されていた。βサブユニットはメチオニン残基を含まないためバンドは観察されなかった。β’サブユニットは4個の断片を生じたが、それらの分子量については記載されていない。この研究ではクローニングされたαサブユニットのcDNA配列から推定したアミノ酸配列についても記載されている。
γ-コングリシニン(7S)
γ-コングリシニンはダイズタンパク質の7S画分であり、これは分子量154〜177 kDaの糖タンパク質で160-162、pIは5.4である160。ある報告によれば、γ-コングリシニンは22
kDaのサブユニット9個を有しているが163、別の研究者はサブユニットは38 kDaの糖タンパク質と32 kDaの単純ペプチドであると報告している164。Yamauchiら162はγ-コングリシニンはいずれも50
kDaの3個のサブユニットを有していると報告している。この研究では、架橋したサブユニットはSDS-PAGEで54.4 kDaの単量体、109 kDaの2量体、及び154
kDaの3量体であった。
グリシニン(11S)
グロブリンの中の11S画分、即ちグリシニン(レグミン)は最もよく研究されている。その分子量は320〜360 kDaで、10〜45 kDaの範囲に及ぶ12個のサブユニットより成る165。酸性のサブユニットの分子量は37〜45
kDa、塩基性サブユニットは20 kDaである166,167。ただしNielsenら168はサブユニットは54.3〜63.7
kDaと測定している。酸性サブユニットA1〜A4、及び塩基性サブユニットB1〜B4はグリシニン分子中に等モルずつ存在する169。酸性サブユニット間では若干の配列の相同性があり、抗原決定基も同じであることから、保存された配列であることが示唆される170。塩基性サブユニット同士も互いにかなりの配列相同性を有するが、酸性サブユニットとは明確に異なる171。未変性のグリシニンの中ではサブユニットは2個の同一の六角形の中に積み重なって詰め込まれており、シリンダー状になっている165。グリシニンのサブユニットの一つはアミノ酸配列が解明されている167。
1. ダイズアレルゲン
ダイズは複数のアレルゲンを含んでいる。Shibasakiら144はダイズにアレルギーのアトピー性皮膚炎患者3人と喘息患者1人から採取した血清を用い、ダイズグロブリン画分11S、7S、及び2SをRAST及びRAST阻害で検討した。特異的なIgE反応性とかなりの程度の交叉反応が全ての画分で認められた。2S画分が全ての画分の間でRAST阻害活性が最も強く、更にRAST試験で50μgの2Sサブユニットが他の画分のIgE結合を90%阻害した。各画分を80℃で30分加熱したところ、2S画分の阻害活性は促進され、一方他の画分の活性は未変性グロブリンの39〜75%に低下した。しかし2S画分の活性も80℃以上の温度では低下した。
ダイズに対するDBPCFCが陽性であるアトピー性皮膚炎患者8人から採取した血清を用いた試験では、7S画分に対する特異的IgE及び11S画分に対するIgGが有意なレベルで存在することが認められた172。殆どの抗原がIgEに結合したが、中でも7S画分が最も強いアレルゲン性を有するようであった。イムノブロットのIgE結合パターンは一定せず、これはどれか単一のダイズ画分がIgEに特に多量結合するわけではないことを示唆している。殆どの血清サンプルで、特定のIgE抗体が7S及び11S両方の画分に結合することが認められた。IgEとの結合は7S画分のα、α’、及びβサブユニット、及び11S画分のA及びB画分で認められた。
Ogawaらによるもう一つの研究では173、殆どのIgE結合バンドは7S画分のタンパク質成分に帰属された。ただし結合はホエイ及び2S由来のバンドでも認められた。SDS-PAGEで16種のダイズタンパク質が検出され、その分子量は14〜70
kDaであった。アトピー性皮膚炎患者10人より採取した血清でイムノブロッティングしたところ、IgE結合バンドが7S画分に認められた。11S画分では結合バンドは殆ど認められなかった。したがってこの研究では、11S画分はダイズに感受性のあるアトピー性皮膚炎患者では重要ではなかった。ただしこれらの患者のダイズに対する過敏性反応はDBPCFCでは証明されなかった。7S画分のIgE結合バンドは40〜70
kDaの範囲で生じ、主要な結合は微量画分である30 kDa画分で認められた。この30 kDaのバンドはGly m 1と命名されている。この30
kDaのバンドは2S、11S、及びホエイ画分では認められなかった。11S画分の酸性サブユニットに対する特異的IgE結合が観察された。7S画分では、主要なIgE結合バンドが10本検出され、これにはβ-コングリシニンのα-及びβ-サブユニットが含まれていた。IgEは2S画分にも結合した。Ogawaら173は、20
kDaのバンドはKSTIであろうと示唆しているが、IgE反応性バンドはこの画分の17及び15 kDaにも生じている。著者等によれば、これらのデータは7Sと他の画分との間にアレルゲン性の交叉反応性が無いことを示すという。しかし、2S画分の20
kDaのバンドとホエイの18〜21 kDaのバンドの間に交叉反応が認められる。この研究では他の研究とは異なり、11S画分はダイズの総貯蔵タンパク質の大部分を占めているにも拘わらず他の画分よりもアレルゲン性が低い。
a. 主要アレルゲン
Gly m 1
Gly m 1はOgawaら173が分子量30 kDaのタンパク質として記載した7Sグロブリン画分の微量成分である。この研究で被験者の65%がGly
m 1に対する特異的IgEを有していた。しかしこれらの被験者はダイズに対する重症の反応やアナフィラキシーを経験したことのないアトピー性皮膚炎患者である。以後に発表された論文で同じ研究グループ174は、未変性のアレルゲンの分子量をゲル浸透クロマトグラフィーで調べ、300
kDa以上であることを見出した。2次元電気泳動による検討で単量体は分子量32 kDa、pIは4.5であった。Gly m 1のN末の15個のアミノ酸残基は、ダイズ種子の34
kDaの油体関連タンパク質(別名ダイズ液胞タンパク質P34)の配列と同じである。加えて、34 kDaの油体関連タンパク質はGly m 1に対して作成された抗血清及びモノクローナル抗体にイムノブロッティングで強く結合した。ミヤギシロ(宮城白)品種のダイズにおける34
kDaの油体関連タンパク質の含量は、ダイズ種子の油脂含量によって異なるものの、種子の子葉の総タンパク質の約5%を占めていると推定されている175。Gly
m 1が7S画分の微量成分としてのみ存在するのは、脱脂ダイズから粗7Sグロブリン画分を調製する際に大部分のこのアレルゲンが除去されてしまった結果かもしれない。
b. 非主要アレルゲン
68 kDaアレルゲン
Ogawaら176はダイズにアレルギーを示すアトピー性皮膚炎患者の血清由来のIgEの25%以上が7Sグロブリン画分の68 kDaタンパク質をイムノブロッティングで認識することを見出した。このタンパク質はβ-コングリシニンのα-サブユニットであり、pIは5.0〜5.2である。この血清は、α-サブユニットを認識したが、α’-サブユニットやβ-サブユニットはα-サブユニットと高度の相同性を有しているにも拘わらず、認識しなかった。
KSTI
職業上KSTIを取り扱っていてダイズアレルギーに罹患している女性がいたことがヒントとなって、アレルギー性タンパク質としてのKSTIの研究が行われた177。この患者はKSTI及びダイズ全体に対する皮膚テストとRASTが陽性であり、他のトリプシンインヒビターやピーナッツ抽出物ではIgE反応性は認められなかった。ダイズに対するRAST反応はKSTIで完全に阻害された。この研究で用いられたダイズアレルギー患者から採血した他の2つの血清はいずれもKSTIに対するRASTが陰性で、また1つだけがダイズに対するRASTが陽性であった。KSTIはダイズ抽出物に対するIgE結合を阻害できなかった。したがって、KSTIは比較的重要性の低いアレルゲンと考えられる。KSTIには栄養摂取を妨げる作用があり、この作用を下げるためにKSTIを低濃度にしか含まない、あるいは全く含まないダイズ品種がつくられている178。KSTIのアミノ酸配列は解明されている179,180。このインヒビターは181個のアミノ酸残基から成る。この研究グループはまたインヒビターに配列変異体があることを見出した。変異体は分子の9つの部位が異なっており、各部位でアミノ酸1個だけが置換されていた。KSTIの分子量は20
kDaである。Brandonら181はKSTIが少なくとも2ヶ所の異なる抗原部位を有しており、そのうちの1つは変性条件下でも保持されることを見出した。この抗原部位はしたがって線状の形をとっている可能性がある。
S-II(20 kDaタンパク質)
Herianら182はダイズ由来の分子量20 kDaのIgE結合タンパク質について記載し、これをS-IIと命名した。ダイズアレルギーを示す被検者から採血した2つの血清サンプルが20
kDaのバンドとのIgE結合を示した。精製したKSTIではIgE結合は観察されなかった。ダイズを炒ると20 kDaアレルゲンへのIgE結合が増強されるようであった。予備試験によれば、S-IIはグリシニンの塩基性サブユニットではない。ダイズにアレルギーを有する被験者から採血した血清サンプルの1つが14
kDaのバンドのみへの結合を示した。ダイズとピーナッツの両方にアレルギーを有する患者の血清が50〜70 kDaの範囲にある数本のバンドとIgE結合を示したが、これらのバンドはβ‐コングリシニンサブユニットと思われる。生のダイズのIgE結合に品種差による相違は観察されなかった。IgE結合タンパク質についてこれ以上の特性検討はなされていない。
2. 構造−エピトープ
グリシニン
グリシニンのサブユニットの抗原性及びアレルゲン性をELISAで調べた研究183,184で、グリシニンに対して作成したウサギの抗血清に全ての酸性鎖が同じように反応した。塩基性サブユニットには反応性はなかった。Nielsenら168は、これらのサブユニットが反応しないのは結合部位が分子の内側に位置しているからであろうと想定した。ダイズにアレルギーを有する10人の成人から採取した血清を用いたIgG-ELISAで、6個の血清サンプルはグリシニンと優先的にIgG結合反応を示したが、単一のサブユニットに特異的な血清は無かった。IgE結合試験で、4個の血清がサブユニットA4と最も強いIgE結合を示したが、他の4個の血清は未変性のグリシニンと最も強いIgE結合を示した。1個の血清はグリシニンとのIgE反応を示さなかったが、サブユニットとは有意な結合を示した。特異的なIgGは未変性のグリシニン分子に対して結合し、一方IgEの結合はサブユニットに向けられている。著者等は、IgE形成には何らかの抗原のプロセシング(加工)が必要である可能性を反映して、IgEの標的は更に断片化された画分に向けられているのではないかと示唆している。しかし、IgE結合はサブユニットでは80%しか阻害されない。したがってグリシニンのアレルゲン性の全てがサブユニットによるものではない。グリシニンの抗原性はβ‐コングリシニンよりもコンフォーメーション依存性が強い185。
Gly m 1
Gly m 1のN末端配列とアミノ酸組成はダイズ種子の34 kDaの油体関連タンパク質のものと同じであり、またパパイン様チオールプロテイナーゼと相同性が高い186。興味深いことに、Gly
m 1はチリダニの主要アレルゲンDer p 1と30%の相同性を有しており、Der p 1もまたチオールプロテアーゼである174。Gly
m 1のN末端配列は
| 10 | |
| K-K-M-K-K-E-Q-Y-S-C- | D-H-P-P-A |
であり、これは34 kDaの油体関連ダイズタンパク質のN末端から最初の15アミノ酸残基の配列と同じである。
68 kDaアレルゲン
ダイズの68 kDa副アレルゲン中のIgE結合部位はアミノ酸配列232〜383の中に位置していると判定された。ダイズにアレルギーを有する患者の血清中のIgEはβ‐コングリシニンのαサブユニットを認識したが、α’−及びβ‐サブユニットはα‐サブユニットと高い相同性を有するにも拘わらずこれらを認識しなかった。α‐サブユニットとα’−サブユニットとは90%以上の相同性を有している187。α‐サブユニット上のIgE結合部位であろうと予想されている残基232〜383はα’−サブユニットの残基258〜417に対応する188。したがって、これら2個のサブユニット間の構造上の差異がダイズにアレルギーを示すこの特定患者集団におけるアレルゲン性の違いの原因なのか否かをより詳細な検討によって決定する必要がある。
3. 用量反応性
アレルギー反応を惹起するに必要なダイズタンパク質の閾値についての情報は殆ど無い。アトピー性皮膚炎の小児患者について二重盲検の誘発試験が行われているが、ダイズに対する感受性は極めて高いというほどではない。Jamesら189はアトピー性皮膚炎患者において、250〜500
mgのダイズが反応を誘発できることを見出した。しかし、ダイズは患者によっては重症の反応を惹き起こすことがあり、現にダイズで栄養強化したソーセージ入りのピザを食べて死亡した子供がいる190。ごく普通に出回っているアレルゲン性食品すべてにいえることだが、感受性の高い人にアレルギーを誘発させるのに必要な、食品の最小量は不明である。
C. ナッツ類
1. アーモンド
Bargmanら191はアーモンドにアレルギーを示す患者7人から採取した血清を用いて、イムノブロッティング法によりアーモンドの抽出物中のIgE結合タンパク質を検出した。2個の主要なアレルゲンが同定された。その1つは70
kDaの熱に不安定なタンパク質であり、もう1つは45〜50 kDaの、熱に安定なタンパク質であった。分子量38〜70 kDaに亘る多数のタンパク質がIgEと結合した。
2. ブラジルナッツ
ブラジルナッツは人によって全身性アナフィラキシーを惹き起こす。Arshadら192はブラジルナッツにアレルギーのある患者の血清を用い、イムノブロッティングによるアレルゲン検出法により、数種のアレルゲン性画分を認めた。ブラジルナッツの主要なアレルゲンBer
e 1はメチオニンを高含量に含む2Sタンパク質であり193、2個のサブユニットより成る。このタンパク質の9 kDaサブユニットは77個のアミノ酸を含む。3
kDaのサブユニットについても報告されている。Ber e 1のcDNA配列は解明されている194。Ber e
1はトウゴマ及びナタネの高メチオニンタンパク質とそれぞれ44%及び21%の相同性を有している。
3. ヘーゼルナッツ
ヘーゼルナッツのアレルギーはヨーロッパの樹木花粉アレルギー患者で特に顕著に見られる(第VII項F参照)。Hirschwehrら195は、カバノキの花粉にアレルギーのある患者のうちヘーゼルナッツで有害反応が起こったと報告してきた25人から血清を採取し、これを用いてIgEが17
kDaのヘーゼル花粉主要アレルゲンであるCor a 1(100%)及び14 kDaのヘーゼル花粉タンパクであるプロフィリン(16%)に結合することを見出した。更にIgEはヘーゼルナッツ抽出物のこれらとほぼ同じ分子量(18
kDaと14 kDa)の画分と結合した。このことはCor a 1および14 kDaのヘーゼルプロフィリンと類似のタンパク質がヘーゼルナッツでも発現されている可能性を示唆する。対照的に、樹木花粉にはアレルギーを示すがヘーゼルナッツに対する過敏症の前歴のない患者18人の血清では、そのうち4人(22%)の血清のみがヘーゼルナッツ抽出物の18
kDaタンパク質へのIgE結合を示し、またヘーゼルナッツプロフィリンに対するIgEの反応性を示したものはなかった。イムノブロッティングによる阻害実験で、18
kDaタンパク質のIgE結合性はヘーゼル花粉の主要アレルゲンであるCor a 1、Bet v 1(カバノキの花粉の主要アレルゲン)195及びBet
v 2 (カバノキの花粉のプロフィリン)196のIgE結合性と類似していることが示された。しかしこのタンパク質は未だ配列決定がなされていない。
4. ピスタチオ
ピスタチオはカシューやマンゴーと同じ科(ウルシ科)に属し、34 kDaの顕著な活性のIgE結合タンパク質を含んでいる197。他のアレルゲンは分子量41〜60
kDaである。ピーナッツ、クルミ、及びヒマワリの種と若干の交叉反応性が認められている。
D. コムギ
米国ではコムギは主要な食料である。穀類について最もアレルギーの訴えが多いのは、埃っぽい環境に曝されることによる職業性喘息である198(第VI項参照)。コムギに含まれるタンパク質は水溶性アルブミン、食塩水に可溶性のグロブリン、70%アルコール水溶液に可溶性のプロラミン、及び酸・アルカリ可溶性のグルテリンである199。
Hoffman200はコムギを摂食して喘息に罹った被験者1人から採った血清を用いて、コムギのグロブリン及びアルブミン画分がRASTで活性が最も強いことを認めた。Suttonら201もコムギに対して高いRASTスコアを示す小児20人の血清を用いて、最も高いIgE活性はグロブリン画分にあることをRASTによる検討で観察した。
食事依存性運動誘発アナフィラキシー(F-EIA)の患者6人において、運動をする30分前にコムギを摂取するとその後アナフィラキシーが発生し、また全員がコムギ抽出物に対する即時皮膚テストで陽性反応を示した202。これらの患者の多くはコムギのトリプシン及びペプシン消化物に対しても陽性の皮膚反応を示した。著者等は、消化によって「ネオ抗原」即ち新規のアレルゲンが生成したのではないかと想定している。しかしこれらの患者は未変性のタンパク質に反応しているわけであるから、完全な状態のタンパク質からポリペプチドがはずれてきたに過ぎないという解釈がより正しいように思われる。