Steve L. Taylor and Samuel B. Lehrer
Food Allergy Research and Resource Program, Department of Food Science
and Technology, University of Nebraska, Lincoln, Nebraska; Department of
Medicine, Tulane University, New Orleans, Louisiana
I. 序論
A. 食物アレルゲン研究の難しさ
食物アレルギーについて不明な点が残っている。食品によって引き起こされる、頻繁で重篤な様々な症状は議論の余地があり、食物アレルギーの正確な定義は未だ確立されていない。多くの食物誘発性過敏症が、長年起こり続けている。多くの食物アレルゲンの標的臓器は充分知られておらず、患者によって異なる。一部の食品は非常に類似している他の食品に比べ、一般的にアレルギー反応をより多く引き起こす。食物アレルギーにおいて重要である免疫グロブリンE(IgE)抗体に加え、その他のメカニズムがあるかどうか未だ解明されていない。多くの食物アレルゲン抽出物を皮膚テストで用いることや、IgE抗体の決定は充分に特性化や標準化がされていないので、食物アレルギーの診断は、未だ困難である。食物に対する副作用の診断のゴールデンスタンダードである二重盲検プラセボ対照食物負荷試験(DBPCFC)でさえ、用いた食品素材の活性や負荷試験の状況と同程度の正確さでしかない(Even
the gold standard for the diagnosis of adverse reactions to foods, the
double-blind placebo-controlled food challenge (DBPCFC), is only as
accurate as the activity of the food material used and the circumstances
of the challenge test.)1, 2。
食物アレルゲンとは何か?いくつかの免疫学的メカニズムは、食物アレルギーにおける病理生理学的メカニズムと関係する。しかしながら、全てではないにしても、ほとんどの場合、即時性過敏症型の食物誘導性アレルギー反応にはIgE介在性の反応が関わると考えられている2。食物アレルゲンは、即時性過敏症を引き起こす、肥満細胞や好塩基球からのメディエーター放出を惹起するIgE抗体産生を誘導し、かつ、それらのIgE抗体と反応する食物成分として定義されている。これは、摂取される食物アレルゲンだけでなく、食品の浮遊アレルゲン(aeroallergens)や接触食物アレルゲンも含む非常に広義の定義である。
古典的な免疫化学的方法と最近発達してきた組み換えDNA技術の応用により、アレルゲンの構造や、アレルゲン決定基の同定について重要な知識が得られた3,
4。アレルゲン構造に関する我々の知識は、主としてアレルゲンのクローニングと配列決定により、急速に増加を続けるだろう。これらの方法は臨床使用のための大量のアレルゲン性素材の供給もするだろう3-5。
B. 食物アレルゲンの特殊な負荷試験
ほとんどの食物アレルゲンは環境中に存在する他のアレルゲンと類似しているが、その他のアレルゲンと幾分異なる多くの独特な特徴がある。第1には暴露である。明らかに食物アレルゲンの主要な暴露は、主に摂取した食物をエネルギーや細胞増殖のため吸収処理する消化管を介する。
この臓器は、ほとんどの分子構造を変化させる様々な加水分解酵素、酸、胆汁塩を含む独特の暴露環境である6。しかしながら、一部の食物タンパク質は、免疫学的活性が残存しており、上皮を通過し、循環系に入り、全身に分布する7-14。食物消化に影響したり、未変化アレルゲンを吸収する因子は明確にする必要がある。さらに、消化されたアレルゲンは摂取した構造と異なる可能性があるので、アレルゲン同定に必要な因果関係の確立が複雑になる。
消化管関連リンパ系組織(GALT)は莫大な量の栄養物抗原に反応しないが、有害な外来物質に迅速に反応しなければならないという点で独特である。GALTはパイエル板と虫垂、粘膜固有層のリンパ球や形質細胞、上皮内のリンパ球、腸間膜リンパ節から成る15。GALTは我々が免疫反応に関する大半の情報を得ている脾臓やリンパ節内の末梢リンパ系組織と異なる反応をする可能性がある。そのような環境において食物アレルゲンは通常の抗原と比較して異なる性質を持つ可能性がある。
食物の暴露は接触(皮膚)や吸収(肺)といった他の経路を介しても生じる。このことは食品産業労働者における職業性反応として記述されている16。吸入による食物アレルギー反応と消化管を介したアレルギー反応の関係や、反応を引き起こすアレルゲンの類似性かつ/または相違性は研究の必要がある。食物アレルギーの病因と関連した吸入アレルゲンと摂取アレルゲンの関係の確立や、規制のための検出限界を確立する観点から重要な、感作を惹起する閾値といった食物アレルゲンについて他の重要な要素の確定も必要である17。
C. 食品の複雑性
食品は様々なアレルゲン性および非アレルゲン性成分を含む複雑な混合物である。食品中のアレルゲンを同定、精製、特性化することは大きな挑戦である。ほとんどの既知食物アレルゲンは水溶性溶媒に溶解する;不溶アレルゲン成分についての情報は基本的にない。上述のように消化過程も食物アレルゲンに影響しうる。実際にGALTと相互作用する食物アレルゲンの性質は摂取した食品の形状とはかなり異なる。
いくつかの食物アレルゲンは微量でも主要なアレルゲンかもしれない。そのような微量アレルゲンの精製や特性化は特に困難である。一部のアレルギーの消費者では、非常に強い感受性のため、微量な混入でさえ、有害な量でアレルゲンが存在する可能性がある。この状況は特定の食品のアレルギー性に関して誤った結論を導きやすい。
近縁の食品の間でも、系統的な関係が特にない無縁もしくは遠縁な素材や食品の間でも、有意なアレルギー交叉反応性が報告されている18,19。マメ科植物19,20や甲殻類19は同じ科で交叉する食品例である。しかしながらこれらの食品群の一つが交叉反応するというだけの事実は、これらの反応が必ずしも臨床的に有意義であることを意味するわけではない。甲殻類は臨床的に重要な交叉アレルゲン性を示すが21,22、マメ科植物の交叉反応性は臨床的に重要でない23。これらの所見は食物アレルゲン反応性に対する理解をさらに複雑にしている。
患者の反応性に関してアレルゲンを系統立てるために、よりよくアレルゲンを記述する以下の分類、体系が展開されてきた。他のアレルゲンと比較し、患者の大部分が反応するアレルゲンは“メジャーアレルゲン”と記述され、また少数の患者が反応する(第7章参照)ものは“マイナーアレルゲン”と記述される。常にではないが一般に、メジャーアレルゲンはアレルゲン抽出物中に存在する主な成分である傾向がある。これらの素材と反応する患者数や、生物学的反応の強さに基づき、メジャーアレルゲンを定義する試みもいくつかされている25-27。一般にメジャーアレルゲンが最大の関心を払われるが、時には感作された患者で重篤な反応を起こすマイナーアレルゲンも無視できない(第7章参照)。
一部の抽出物は、同じような物理的、化学的、免疫化学的構造を持っているが、わずかに等電点が異なるアレルゲンを含有し24、アイソアレルゲン(isoallergens)という用語は同じ原料から単離された分子に用いられている。このようなアレルゲンに観察されるわずかな差異は、分子の糖部分の軽度な差異(グリコシル化の程度)やタンパク質のアミド化の程度、遺伝的多様性に起因する28。
II. 食物アレルゲンの性質
A. 一般的なアレルゲン性食物タンパク質の特徴
食品は様々な異なるタンパク質を含有するが、アレルゲンとして知られているものは少数のみである。ダイズやピーナッツのような植物性食物において、アレルゲン性タンパク質の多くは、一部の食物に多量に存在する貯蔵タンパク質であり29-31、アレルゲン性の可能性は特定のタンパク質が暴露する程度と相関すると結論させる可能性がある。しかしながら、少量しか存在しないタンパク質もメジャーアレルゲンとして働く。例えば、タラのメジャーアレルゲンであるGad
c 1は特に顕著なタンパク質ではない32。また、牛肉、豚肉、鶏肉中のアクチンやミオシンといった多くの主要タンパク質にはアレルゲン性がない。暴露量は決定的な因子であるようだが、タンパク質の免疫原性がより重要である。
宿主起源分子は通常免疫系に認識されないため、全ての抗原と同様に有意な免疫反応を刺激するには食物アレルゲンは宿主に対して外来の分子でなければならない。ほどんどの食物アレルゲンは食品加工や調理、消化過程に抵抗性のある高度に安定な分子である33。しかしながら、りんごや新鮮な果物や野菜に存在する不安定なアレルゲンといった例外も存在する34,35。一般にそのような不安定なアレルゲンは分解後アレルゲン活性を失うため、口腔粘膜に限定された反応を起こす。反対に、消化によるアレルギー反応を誘発するような新規エピトープの放出や露出による抗原の変化の可能性があるが、よく研究されていない。
従来、粘膜透過性は食物アレルギーの重要な要因と考えられてきた。多くの食物タンパク質が消化管の粘膜を通過し、健常者ですら、免疫応答を引き起こす13,36。しかしながら、健常者と食物アレルギー患者とのアレルゲンの粘膜吸収の差異はあまり研究されていない;消化管透過性の現象と食物アレルギーの関係も解明されていない。これは巨大な分子がより容易に消化管上皮を通過し、アレルギー感作を誘発する、消化管バリアの成熟する前の乳児には重大な問題である6。
最後に、摂取される食物タンパク質の性質がある。飲食物の一般的な構成要素であるいくつかの食物は全くアレルギー性がない。例えばタンパク質を多く含む牛肉や豚肉はアメリカ人の食事において重要な食物である。しかしながら、牛肉や豚肉は、主要なアレルゲン性食品である魚介類に比べ、一般に食物アレルギーを引き起こさない。牛肉や豚肉もエビのメジャーアレルゲンとして同定されている筋タンパク質のトロポミオシンを含むので、特に興味深い37-40。ニワトリとエビのトロポミオシンはかなり(60%)のアミノ酸配列相同性を持つが、アレルギー反応性は随分異なる。牛肉、豚肉、鶏肉に存在するトロポミオシンはアレルゲンではないが、エビのトロポミオシンと他の甲殻類におそらく存在するであろうトロポミオシンは非常に強力なアレルゲンである。分子のアレルゲン性に寄与する又はアレルゲン性を減少させる、構造の差異はさらなる研究の重要な課題である。
B. アレルゲン性食物タンパク質の生化学的および免疫化学的な特徴
全てのアレルゲンは、脱顆粒を起こすために、肥満細胞表面上のIgE分子を架橋できなければならないため、分子の大きさを必要とする。従って、これらのアレルゲンは、メディエーターの放出を誘発するため、少なくとも2つのIgE抗体反応部位(IgE
antibody-reactive
sites)(B細胞エピトープ)を持たなければならない。しかしながら、21アミノ酸から成る有毒ペプチドであるメリチン41のような1価アレルゲンでもマウスにおいて好塩基球や肥満細胞からのヒスタミン遊離やアナフィラキシーを誘発することが知られている。これらの分子は好塩基球/肥満細胞表面上のIgE抗体と結合する能力を持つ。メリチンはIgEに結合して凝集するか、又は凝集してIgEに結合し、1価のアレルゲンからアレルギー反応を引き起こすことが可能なポリリガンドに変化する。メリチンは又、巨大分子に結合することでハプテンとして働き、続いてIgE架橋を引き起こすような複合体として働くが、アレルギー病においてin
vivoでこのようなことが起こり、アレルギー反応における実質的な要因であるかどうかは未だ確定されていない。
ほとんどの既知食物アレルゲンは分子量が10,000から70,000Daである19。より低分子のものが免疫原性を持つ可能性はあるが、分子量10,000Daがおそらくアレルギー応答の下限である。上限はおそらくより大きな分子が粘膜吸収を制限されることによる19。しかしながら、ピーナッツアレルゲンのAra
h 1(分子量63.5 kDa)やAra h 2(分子量17kDa)は42,43、天然では200〜300kDaの大きさの巨大タンパク質重合体として存在する。そのような巨大分子がアレルゲンとして働くのか、もしくは消化過程で解離するのかは明白でない。ほとんどの食物アレルゲンは酸性の等電点を持つ糖タンパク質である。しかしながら、これはほとんどの抗原の性質であり、必ずしも食物アレルゲン独自の性質ではない。アレルゲンは全てタンパク質であるが、全てのタンパク質がアレルゲンとなる訳ではない。多くのアレルゲンには少糖類付加といった翻訳後修飾がある。
いくつかの食物アレルゲンは生化学的構造が決定されている。(本号のRobert K. BushとSusan L. Hefleによる
「食物アレルゲン」参照)。様々なアレルゲン性タンパク質の生化学的構造を比較した場合、アレルゲンを、特に食物アレルゲンを表すような一貫した普遍的な構造パターンはみられない。アレルゲン性タンパク質の一次アミノ酸配列の比較では独自のもしくは典型的なパターンを示さなかった。α
ヘリックスやβシート(beta strand)、ループといったタンパク質の三次構造に特殊なパターンはみられなかった44。アレルゲンの一次構造を他のタンパク質と比較した場合、アミノ酸配列は環境中の多数のタンパク質と類似性がある。全生物の進化の観点から、これは驚くべきことではないだろうが、他のタンパク質と異なるような未発見のアレルゲン構造が未だ存在する可能性を示している。
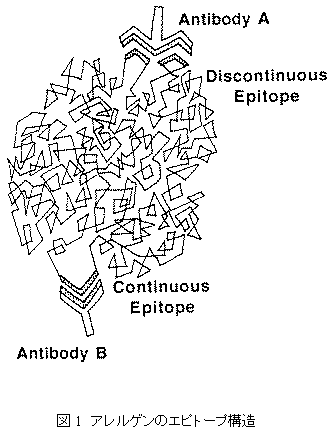
免疫系細胞や特異的抗体と相互作用する抗原アレルゲンの表面部位はエピトープと定義される。T細胞と反応するエピトープはT細胞エピトープと呼ばれ45、抗体や抗体生産をするB細胞と反応するものはB細胞エピトープと呼ばれている44。

エピトープは高次構造的なものも、直線状なものもある。高次構造的なエピトープはタンパク質の3次構造か、タンパク質表面上のいくつかのアミノ酸配列によって決まる。直線状のエピトープはタンパク質の一次アミノ酸配列により決まる。一般の意見は、T細胞エピトープは直線状だが、B細胞エピトープは高次構造的というものである。しかしながら、この法則には例外もある44。定義によれば、全てのB細胞エピトープは分子の外表面になければならない(図1)。エピトープが共有結合した一連のアミノ酸からなる場合、連続エピトープと呼ばれている。立体構造を介して1つのエピトープを形成する2つの異なるアミノ酸配列から成るエピトープは不連続エピトープと呼ばれている。不連続エピトープの研究は技術的により厳しいため、一般的に連続エピトープに関してより多くの情報が入手可能である。連続エピトープの最小のアミノ酸残基数は8であるが46、不連続の高次構造的エピトープは16以上である44。
T細胞はもっぱらタンパク質分解により短いペプチドへ処理されたタンパク質抗原を認識する。アレルゲンの抗原提示細胞(APC)による食作用の後にのみタンパク質抗原はT細胞レセプター(TCR)によって認識される46。X線結晶解析による構造解析では、ペプチドはTCRのα1、およびα2ドメインのαヘリックス間の提示分子の割れ目に延ばされて配置されている46。APCによる抗原処理は抗原のタンパク質分解消化および、APC表面のHLAクラスII分子のペプチド収容溝(peptide
binding
groove)でのペプチド断片の提示から成る。そしてTCRは主要組織適合複合体(MHC)II溝(groove)内のエピトープに特異的に反応する。MHC分子から溶離したペプチドの化学分析は、それらが通常8から9アミノ酸残基長であることを確立した46。アレルゲンのT細胞エピトープの完全なレパートリーの決定には、患者毎に異なる認識サイトの数と可変性(variability)のため、課題が山積している。
食物アレルゲンのT細胞エピトープについての知識は花粉のような非食物起源のものから主に推論されたものだが、食物アレルゲンは独自の特徴を持っている。食物アレルゲンはGALTや全身の他のリンパ性細胞により認識される。これらの系のT細胞応答の免疫調節機構ははっきり示されていない;したがって食物アレルゲンのT細胞エピトープには独自の特徴がある可能性がある。T細胞エピトープは未梢血単核球中のT細胞や、天然のアレルゲンに感作された患者由来のT細胞クローンに反応を誘発する能力を基に、重複するペプチドの解析によって同定される可能性がある。しかしながら提供者の相当量の血液が必要なため、これらのデータは材料の入手可能性により制限される。免疫治療の基礎として、非応答性の誘発に基づいていたり、動物で確立した免疫応答がダウンレギュレーションされるT細胞エピトープペプチドにかなりの関心がある47。T細胞反応性ペプチドによる免疫治療は熱心に研究されている。

B細胞エピトープペプチドにはアミノ酸配列に独自な、または共通なパターンはみられない(表1)。連続エピトープに特異的な抗体は不連続エピトープ特異的な抗体に比べ常に親和性が低い44。抗体親和性の観点から見ると、ほとんどのアレルギー患者の産生する抗体は不連続(高親和性)エピトープに特異的である44。この一般則が食物アレルゲンに適用できるかは未だ不明である(表2)。エピトープ内にはおよそ8から16のアミノ酸残基が存在するが、各アミノ酸残基が等しく総結合エネルギーに寄与しているわけではない44,46。
タンパク質抗原表面は潜在的なB細胞エピトープでおおわれている;しかしながら、それら全てが等しく反応するわけではない。実際、多くは認識されない。B細胞エピトープを予測する方法は存在するが、全体として成功していない。例えば、極性と非極性のアミノ酸残基の計算に基づくアルゴリズムは分子の表面に位置するアミノ酸残基の予測に用いられている。しかしながら、ホストの応答が各個人が反応するエピトープを決定するので、この情報は不完全である。
C. 栽培学的な考慮
栽培学的条件の結果として、食物中の個々のタンパク質の種類や量に変動が生じる可能性がある。例えば、ダイズに含まれるグリシニン48やピーナッツに含まれるアラチン49は栽培学的条件により影響を受ける。しかしながら、そのような条件が特定の食物のアレルゲン性に影響を与えるかを確認した研究はない。
食物の個々のタンパク質の種類や量も品種や栽培品種によって変わる可能性がある。そのような条件が特定の食物のアレルゲン性に与える影響を確認する、非常に限定された研究が行なわれた。アーモンドのIgE結合タンパク質は3大品種(ノンパレル(Nonpareil)、ミッション(Mission)、カーメル(Carmel))で類似している50。フロランナー(Florunner)とバージニア(Virginia)ピーナッツは阻害イムノアッセイでのピーナッツ特異的IgE結合能がかなり等しい51。一部の新鮮なアボガドによるアレルギー患者は一般的な2品種のうち1種にのみ反応するが、ほとんどの患者は両品種に反応する52。パン屋喘息の主要職業性アレルゲンである小麦の特異的な27kDaのアルブミンの量はドイツで一般に使用されている小麦7栽培品種の間で異なっている53。
植物や動物の発生段階も特定のタンパク質やおそらくアレルゲンの性質や量に影響する。この場合もこの可能性についてわずかな研究しか行なわれていない。ダイズもやしは阻害イムノアッセイでのダイズアレルギー患者IgE結合能はダイズ種子と同等である54。
D. アレルゲン性タンパク質の物理的および化学的特徴
食物アレルゲンは典型的な加工や前処理に抵抗性である傾向がある。これらのタンパク質は加熱、酸処理、タンパク質分解、消化に比較的抵抗性である。しかしながら重要な例外は存在する。これらの抵抗性の特徴は、遺伝子工学により未知のアレルゲン性の可能性が移動もしくは発達した、特定のタンパク質の潜在的なアレルゲン性の評価に有用である可能性があるが、試験の組み合わせがそのような評価の信頼性増加に用いられなければならない。
1. 耐熱性
多くのアレルゲン性食物タンパク質は熱に耐性である。しかしながら、熱に不安定な食物アレルゲンがいくつか同定されている。加熱はタンパク質の変性とIgEが結合する構造的なエピトープの消失を促進する。熱変性に対し、いくつかの食物アレルゲンが耐性であることは、食物アレルゲンに関しては構造的なエピトープがIgE結合のために常に重要であるわけではないことを示唆している。牛乳タンパク質はこの件について最も広く研究されている。加熱処理はホエイタンパク質の抗原性を減少しうるが、カゼインの抗原性にはほとんど影響しない55。しかしながら、ホエイタンパク質は高熱処理でアレルゲン性が一部保持される55-57。β-ラクトグロブリンや牛血清アルブミン(BSA)のIgE結合能は、80〜100℃、15分間の加熱により減少する。対照的にα-ラクトアルブミンやカゼインのIgE結合能はわずかな変化しか見られない57。一部の患者血清中のIgE抗体は100℃、3時間で高温加熱後の牛乳タンパク質とさえ有意に反応する57。この牛乳アレルギー患者の熱処理牛乳タンパク質に対する反応の不均一性は低アレルゲン化処理として加熱処理を使用することの難しさを示している57。
その他のほとんどの食物アレルゲンも熱に耐性である。タラの主要アレルゲンであるGad c 1は、熱に対し耐性である58。えびの主要アレルゲンは熱に安定であり59-61、調理に用いられる水から単離される60,
61。米のグルテリンやグロブリン画分のイムノアッセイによって評価されたIgE結合活性は、60℃、1時間もしくは100℃、2〜10分間の加熱により40〜70%減少する62。ダイズの7S-および11S-グロブリン分画はダイズ特異的IgEと結合するが、その結合活性は80℃、30分間の加熱により、消失はしないが減少させることが可能である63。後に、Burksら30は非加熱ダイズと比較し、80℃、60分間加熱したダイズタンパク質7Sおよび11S画分を用いた試験で、ダイズアレルギー患者血清由来のIgE力価が減少することを示した。この条件で、ダイズタンパク質のホエイ画分を用いた際にIgE力価に変化は見られなかった。120℃、60分間加熱後のダイズタンパク質の3つの画分を用いた試験では、IgE力価にかなりの減少が見られた30。さらなる実験において、3つの主要ダイズタンパク質画分のIgE結合能は、37℃60分、56℃60分、100℃5分、100℃20分、100℃60分の加熱によりほとんど影響を受けなかった31。
同様の加熱条件により、ピーナッツ粗抽出液と2つのピーナッツ主要アレルゲンであるAra h 1およびAra h 2は影響を受けなかった31。ピーナッツ主要アレルゲンの一つであるコンカナバリンA結合性糖タンパク質のIgE結合能は、最高100℃、pH2.8〜10のpH域に渡って安定である64。非加熱のピーナッツは、高温で不安定なアレルゲンも含むようである65。エンドウ豆アルブミン画分のアレルゲン活性は加熱や煮沸の際に、完全に保持される66。綿実のアレルゲンは非常に熱に安定である18。卵白の主要アレルゲンであるオボアルブミンとオボムコイドは比較的熱に安定であり、調理した卵で免疫学的に検出が可能であるが、コナルブミンは安定性が低い67。オボムコイドは100℃、長時間加熱でも患者血清IgEとの結合能が保持されるが、4℃で12日間保存した卵からのオボムコイドは新鮮な卵のものより、100℃、長時間加熱に対し、わずかに安定性が低い68。ある研究において、オボアルブミンの熱変性はアレルゲン性にほとんど影響しないが69、他の研究では熱変性オボアルブミンは未変性のものと比較してIgEへの結合がかなり低い70。
一部の食物アレルゲンは熱変性に対し非常に感受性が高い。新鮮な果物と多くの野菜が良い例である35。りんごに関しては、りんごの新鮮な抽出物での皮膚プリックテストは陽性であったが、175℃、30分間の加熱をした抽出物では陰性であった34。その他の食品も熱に安定なアレルゲンと熱に不安定なアレルゲンを含んでいる;先に述べた通り、ピーナッツが良い例である65。
食物アレルゲンは熱変性に耐性である傾向があるが、この性質はもちろん普遍ではない。遺伝子技術により得られる特異的なタンパク質の潜在的なアレルゲン性の評価に熱変性を使用することには問題がある。加熱処理されたタンパク質の免疫原性応答を誘導する能力はIgE反応系で評価すべきである。特異的タンパク質の、熱に対する他の生物学的活性の安定度の評価から、熱に対する免疫原性またはアレルゲン性の安定度を予測することはできない。
2. 消化、タンパク質分解、加水分解に対する抵抗性
ほとんどの食物アレルゲンはタンパク質分解や加水分解に抵抗性である71。加熱処理はタンパク質変性と高次構造的なエピトープの喪失をもたらすが、ポリペプチド鎖の酵素もしくは酸による切断は高次構造的、および直線状(linear)エピトープの両方を破壊する可能性がある。しかしながら、消化、タンパク質分解、加水分解に対する食物アレルゲンの安定性情報量は比較的乏しい。
消化が食物タンパク質のアレルゲン性を増強することを示唆する研究は極めて少ない。Haddad72らは一部の牛乳アレルギー患者血清IgEが、β-ラクトグロブリンのタンパク質消化物に対して未消化のものに比べ強く反応することを報告した。Schwartzら73はペプシン消化によりβ-ラクトグロブリンの結合能は減少しないと報告した。牛乳タンパク質の限定的なタンパク質消化ではIgEとの結合能は減少しないが、徹底的な加水分解ではかなりアレルゲン性が低下する74,75。トリプシンによるホエイタンパク質の加水分解は、モルモットにおいて感作能のみられない部分的加水分解物をもたらした76,
77。この加水分解物で調整される市販幼児用調合乳は20%未満の遊離アミノ酸、鎖長が10〜15アミノ酸までの検出可能なペプチド、および少量(約1%)の鎖長27アミノ酸の分子量3000までのタンパク質が含有される78。これらの、牛乳特異的IgEが反応する可能性のあるタンパク質は、牛乳に感作された乳児の間でこの調合乳による副作用が生じる根拠となり79,
80、一部の牛乳アレルギー患者血清と、これらのホエイ部分加水分解物への有意なIgE結合により実証された81。
ホエイタンパク質に対するペプシンとトリプシンの併用では加水分解の程度が増し、IgEへの結合がみられなくなった82。ホエイタンパク質がBacillus
lichenformis由来のアルカリプロテアーゼにより加水分解され、生じたペプチドがゲルろ過により、分子量に従って分離された83。分子量が6kDa以上のペプチドはマウスに対して局所的な過敏反応を誘発するが、それより小さなペプチドでは誘発せず83、徹底的な加水分解はホエイタンパク質由来のアレルゲン性ペプチドの除去に必要かもしれない。市販プロテアーゼ混合物によるホエイタンパク質の部分的加水分解により、加水分解の程度がそれぞれ20.8%、12.4%の2種の加水分解物を作成した84。これらの加水分解物はIgE結合がかなり減少したが、IgE反応性は完全には破壊されなかった84。加水分解物の限外ろ過によりIgE結合活性の検出されない加水分解ホエイろ過物が得られた84。
ヒトにおけるカゼインのアレルゲン性に対する消化や部分的加水分解の影響は調べられていない。ウサギでは、分子量3500〜5000のカゼインペプチドは完全なタンパク質と同程度の免疫原性を持つが、より小さなペプチドでは免疫原性が1000倍減少する85。カゼイン部分加水分解物は免疫原性をある程度保持する傾向があるが、用いたタンパク質分解酵素の特異性が、残留物の免疫原性に一部影響している86。徹底的なカゼインの加水分解は、一般に低アレルゲン乳児用調合乳に使用されている、アレルゲン性が非常に低減した産物をもたらす75,
87。これらカゼイン加水分解物の綿密な研究により、70%の遊離アミノ酸と鎖長が5〜8アミノ酸までの検出可能なペプチドが含有されることが示された78。カゼイン加水分解物へのIgE結合は一部の患者では認められる81。
その他の食物アレルゲンもタンパク質分解や消化に抵抗性を示す。タラのアレルゲンであるGad c 1はタンパク質分解に抵抗性である;Gad c
1の低分子のペプチド断片はIgEへの結合能を保持している88-90。しかしながら、トリプシン、ペプシン、サブチリシン、プロナーゼによるタラアレルゲン抽出物の徹底的な分解によりIgE結合能は消失する。エラスターゼ(elastase)加水分解と、消化でのタンパク質分解のシミュレーションでは部分的なIgE結合能の消失作用しかなかった91。同様に、卵白の主要アレルゲンであるオボムコイドやオボアルブミンのIgE結合能も、タンパク質分解による影響を受けず、IgE結合能のあるペプチドフラグメントを単離するという結果であった69,
70, 92。
ダイズ抽出物のIgE結合能はトリプシン、キモトリプシン、腸管ペプチダーゼ混合物による加水分解に続いてペプシンによる加水分解を受けると、IgE結合能が1/10に減少した31。同様のタンパク質分解により、ピーナッツ抽出物のIgE結合能は1/100に減少した31。ダイズタンパク質の徹底的な加水分解では、ウサギに対する免疫原性のない加水分解物が得られた93。同様の結果が、モルモットにおいて加水分解コラーゲン/ダイズタンパク質で得られた94。
IgE介在性の運動誘発性アナフィラキシー患者グループに対する小麦抽出物の皮膚テスト反応性は、トリプシン処理により破壊されたが、ペプシン処理では破壊されなかった95。トリプシン加水分解とペプシン加水分解では生じるペプチドの分子量は類似している。しかしながら、トリプシンによる部分的加水分解は小麦タンパク質のIgE結合エピトープを破壊したが、ペプシンによる加水分解ではこれら同じエピトープに対して実質的に影響しなかった95。低アレルゲン性の小麦粉は可溶化した小麦タンパク質をアクチナーゼ、コラゲナーゼ、トランスグルタミナーゼ処理によって開発されてきた96。
綿実の主要アレルゲンはペプシン加水分解により影響されない97。アクチナーゼによる加水分解により米アレルゲンが大きく不活化される可能性がある一方、パパインは米アレルゲンのIgE結合活性を低減させた。ペプシン、トリプシン、キモトリプシン、パンクレアチンはこのアレルゲン活性に影響しなかった98。
タンパク質は臭化シアンのような特異的試薬又は、濃塩酸処理のような非特異的方法による化学的な手段を介して加水分解される可能性がある。アレルゲンの化学修飾はこれらタンパク質アレルゲン性低減のための別の方法を示しているかもしれない。オボムコイドの臭化シアン切断処理はそのIgE結合活性に影響しなかった92,
99。しかしながら、この処理はオボアルブミンのアレルゲン性を減少させた69, 99。尿素、塩酸(pH
3.0)、ジチオスレイトールによるオボアルブミンの変性は、IgE結合活性を減少させなかったが、水酸化ナトリウム処理(pH
11.0)ではIgE結合活性が消失した70。
一部の食物アレルゲンはタンパク質分解や消化に対する感受性が高い。新鮮な果物は一般に口腔アレルギー症候群(OAS)患者に症状を惹起する100,
101。一見、新鮮な果物のアレルゲンは、胃腸管で容易に消化され、全身性に影響しない。しかしながらこの学説は綿密に評価されてはいない。
ほとんどの食物アレルゲンは、消化、タンパク質分解、これ以外の加水分解に抵抗性である。しかしながら、その研究結果は、実験で用いられた酵素的もしくは化学的処理の性質や、加水分解物の免疫原性の評価方法の選択、それほどではないにせよ、評価する特定の食物アレルゲンによって決まる。タンパク質の加水分解抵抗性評価は、特定のタンパク質の潜在的なアレルゲン性に関して価値ある情報を提示する可能性があるが、厳密な試験手順は確立されていない。タンパク質分解評価手順は、消化のタンパク質分解を模していて、単離したタンパク質や適切な食品基質(food
matrix)内のタンパク質の試験を含むことが理想的である。
動物モデルにおけるホエイ部分加水分解物の免疫原性評価の経験は、そのような動物モデルから得られる結果の評価に細心の注意が取られることを決定づける。消化、タンパク質分解、加水分解に対する、食物アレルゲンと食物タンパク質を比較した安定性のさらなる研究データの進展は、特定のタンパク質の潜在的なアレルゲン性の評価を目的としたツールの有用性を決定するのに強く望まれる。
3. 溶解性
ほとんどの食物アレルゲンは水および/または塩類溶液に溶解するので、アルブミン(水に可溶)やグロブリン(塩類溶液に可溶)のようなクラスに分類される102。しかしながら、多くの食物タンパク質はこれら2つの溶解性カテゴリーに分類されるので、この特性はとりわけ特徴付けるものとはならない。食物タンパク質はまた、アルコールに溶解するか(小麦のグリアジンのようなプロラミン)、そうでないか(例えば小麦のグルテリン)だろう。これら2つのカテゴリーのタンパク質はアレルゲンとして分類されることはあまりなかった。しかしながら、タンパク質のこれら2つのカテゴリーはそのアレルゲン性の可能性についてあまり調べられていなかった。時には、これらのタンパク質がIgEを介したアレルギーに関係している。例えば、小麦グルテンに対するIgE抗体が、少数の小麦アレルギー患者で確認されている103。さらに、小麦、ライ麦、大麦、オーツ麦の不耐症と関連した細胞性免疫反応を伴うセリアック病は、ある種のグリアジンペプチドにより引き起こされる104。近年、Gad
c 1を含む可溶性タンパク質が徹底的な洗浄によって除去されたタラすり身で、タラアレルゲンが確認された105。
4. 耐酸性
食物アレルゲンは通常、穏和な酸処理に対してかなり安定である33。一般的に食物アレルゲンの胃酸の条件を模した酸濃度での酸処理はほとんど影響しない。このような酸性条件で新鮮果物のアレルゲンが不安定性であることは、例外として既に記載されている。より典型的な事例として、ピーナッツ主要アレルゲンの1つである65kDaのコンカナバリンA結合性糖タンパク質はpH
2.8で安定である64。主要な卵白アレルゲンの1つであるオブアルブミンはpH 3.0で安定である70。胃酸を模した条件下の免疫原性の消失の証明は、あるタンパク質の潜在的なアレルゲン性を評価するための補足的基準となる可能性がある。食物アレルゲンの酸安定性の比較も限られた情報しかない。補足データ収集は考慮すべき重要な課題である。
5. アレルゲン性に関わるアミノ酸化学修飾の影響
IgEの結合するエプトープ内アミノ酸が修飾される可能性のある化学修飾は、アレルゲン特異的IgEへの結合を減少させる。このアプローチはIgE結合エピトープ内のアミノ酸同定に意義があるが、概して食品処理では実用的な価値があまりない。この戦略を用いた初期の試みの1つとして、LeeとSehon106はポリエチレングリコール処理によりオボアルブミンのIgE結合が減少することを観察した。Gad
c
1のリジン、チロシン、トリプトファン、アルギニン側鎖の化学修飾や、このタンパク質に結合している2つのカルシウムイオンの放出もIgE結合の有意な減少をもたらした107。Gad
c 1の重合は同様にアレルゲン活性の減少をもたらした107,108。
その他のアプローチも特定の食物アレルゲンのIgE結合を減少させるが、これらは一般則というよりも例外である。対照的に乳糖とβ−ラクトグロブリンの反応によって牛乳アレルギー患者における牛乳タンパク質の皮膚反応性が増加し109、特定の状況下で褐変反応がアレルゲン性を増強する可能性を示している。
様々な食物タンパク質のアレルゲン性に対する化学修飾の影響は、非常に特異的であるようであり、アレルゲンエピトープのアミノ酸配列と関連しているようである。遺伝子改変タンパク質の潜在的アレルゲン性の普通的な評価にそのようなアプローチを用いることは不可能であろう。
III. 食物アレルゲンに対する加工の影響
A. 加熱処理
食物アレルゲンは一般的に熱やタンパク質分解酵素に耐性であるため、食品加工は様々な食品のアレルゲン性の除去に特に有効ではない。いくつかの注目すべき例外が存在する。例えば、新鮮な果物のアレルゲン性は果物の缶詰製造やジャムの製造で生じるであろう加熱によりかなり容易に除去される101。スライスしたりんごのアレルゲン性は室温保存により減少し34,
110-112、おそらく、一部のアレルゲンの変性し易さの別の指標が新鮮な果物において明らかになっただろう。しかしながら、新たに摘んだりんごのアレルゲンは、りんごがスライスされていない場合、保存中に増加する112。さけに存在するアレルゲンは、さけアレルギー患者が缶詰のさけに対し寛容であるという研究から、市販の缶詰に用いられる加熱処理により破壊されるようである113。しかしながら、魚アレルギー患者がしばしば調理した魚でアレルギーを起こすことがあり、加熱処理の程度は重要な変数となる。
いくつかの職業性食物アレルゲンは熱に不安定である。未熟なコーヒー豆にはアレルゲン性があるが、焙煎したコーヒー豆にはそれがなく、熱に不安定なアレルゲンの存在を示唆している114。カカオ豆のアレルゲンはチョコレートに加工されることにより破壊されるが、確実な加工操作は確認されていない115。カカオ豆は相当な熱処理を受けるため、熱変性と同時におそらく化学修飾を受けているようである。
ほとんどのアレルゲン性食物は、製造や前処理での一般的な加熱処理時にそのアレルゲン性を保持している。牛乳とその2つの主要タンパク質画分であるカゼインとホエイは過酷な熱処理にさらされた場合でもアレルゲン性を保持している55,
116-119。これらの過酷な加熱処理は牛乳の栄養学的な質に悪影響を及ぼす116。牛乳は報告によれば、濃縮、エバポレーション、乾燥といった、一般的な加熱加工処理後にアレルゲン性を保持している119。
非加熱およびローストしたピーナッツは両方ともアレルゲン性があり、ピーナッツ特異的IgEに結合する51, 65。ピーナッツバターやその他の様々なピーナッツ粉末を含む、ほとんどの市販ピーナッツ加工製品はアレルゲン性を保持している51。非加熱およびローストしたダイズも同様にIgE結合するタンパク質を含有している29。脱脂ダイズの酸・アルカリ抽出により調整された、分離ダイズタンパク質は、IgEとの結合能は減少するが、アレルゲン性が一部残存している29。その他のダイズ粉末、ダイズタンパク質濃縮物を含む、乾燥にもさらされたダイズ製品は、IgEに結合するタンパク質のほとんどが保持されている29。茹でた卵はIgEへの結合能を保持している68。
B. 酵素によるタンパク質分解
酵素によるタンパク質分解は、様々なアレルゲン性食品中のアレルゲン性の除去に必ずしも効果的ではない。タンパク質分解の程度は非常に重要な変動要因であろうが、むしろ徹底的なタンパク質分解がアレルゲン性食品タンパク質のアレルゲン性の完全除去に必要だろう。監督官庁は一般に、徹底的および部分的な加水分解タンパク質を区別した規制をしていない。牛乳は最も研究された例である。Jostと共同研究者により報告された76,77ように、ある乳児用調合乳がホエイタンパク質の部分加水分解を使って開発された120。いくつかの研究ではこの製品が新生児に投与され、典型的な牛乳調合乳に比べ感作が少なかったが121-123、その他の研究では差がみられなかった124,125。このホエイ部分加水分解物調合乳は既に牛乳に感作された一部の乳児にアレルギー反応を誘発した79,80,126。アレルゲン性タンパク質を構成アミノ酸にする完全な加水分解により、タンパク質へのIgE結合能が破壊されることが予測される。実際、最も広く市販されている低アレルゲン性幼児用調合乳は徹底的に加水分解されたカゼイン加水分解物に基づき調製されている。しかしながら、カゼイン加水分解物調合乳に対してさえ、高度に感作された幼児でアレルギー反応を起こすことが時折報告されており126-128、そのような調合乳の加水分解率は85%以上であるので、注目に値する93,129。Wahnら87は、カゼイン加水分解物調合乳は残在するアレルゲン活性がほとんどないことを報告した。しかしながら、カゼイン加水分解物が免疫原性を示しうる大きさのペプチド断片を含むことがある83,130。
調味料として販売されている徹底的に加水分解されたピーナッツタンパク質は、ピーナッツ特異的なIgEに結合しなかった51。しかしながら、おそらく加水分解の程度がダイズアレルゲンのIgE結合エピトープを破壊するのに不充分だったため、市販および酸加水分解したダイズから作られた野菜タンパク質(HVP)はダイズアレルギー患者の血清IgEに結合した54。真菌により加水分解された醤油、テンペ、豆腐、味噌といった発酵性ダイズ製品もアレルゲン性を保持しているが、IgE結合活性のレベルは生のダイズ抽出物と比較して減少していた54。
低アレルゲン性小麦粉はアクチナーゼ、コラゲナーゼ、トランスグルタミナーゼによる可溶性小麦タンパク質の処理を介して開発されてきた96。同様に低アレルゲン性米も、米のタンパク質分解酵素処理を介して開発されてきた98。この調製は米アレルギー患者の治療に極めて効果的だった131,132。ホエイタンパク質濃縮物からのβ−ラクトブロブリンの選択的消化が、高静水圧下(1000〜3000
kg/cm2)でサーモリシンを用いて実施された。その産物はβ−ラクトブロブリンを欠くが、α−ラクトアルブミンや他の一般的な牛乳アレルゲンが豊富である133。
C. 油の抽出
加工中の全タンパク質またはアレルゲン性タンパク質のみの除去(removal)もしくは排除(exclusion)は、食品アレルゲン性を明らかに除去するだろう。ピーナッツ、ダイズ、ヒマワリ種子といった脂肪種子からの高温溶剤抽出法による食用油の抽出は、タンパク質の全痕跡を除去する。これは結果としてアレルギー患者の摂取する油が安全となる134-136。しかしながら、Porrasらはヨーロッパからのダイズ油のサンプルの全てではないが一部にダイズタンパク質を同定し137、油の抽出は常にはタンパク質もしくはアレルゲンを完全に除去出来ない可能性を示した。ダイズタンパク質は一般的な食品成分であるダイズレシチンのサンプル中にもしばしば検出された137。同様に牛乳由来の非タンパク質成分が微量の牛乳アレルゲンを含む可能性がある。例えば乳糖はアレルゲン性夾雑物を含みうる138。
D. その他の加工
その他のアプローチはいくつかの食物アレルゲンのIgE結合を減弱するかもしれないが、これらは一般則というよりも例外の傾向がある。りんごアレルゲンはフェノール性褐変(phenolic
browning)により不活化される110。凍結乾燥はいくつかの魚抽出物のアレルゲン性を減少させる可能性がある。魚アレルギー患者は調理した魚の非凍結乾燥物にオープン負荷試験(open
challenges)では陽性を示したが、凍結乾燥物の二重盲検プラセボ対照食物負荷試験(double-blind,
placebo-controlled challenges)では陰性であった32。しかしながら、凍結乾燥はかなりまれな食品加工操作であり、凍結乾燥した魚はほとんど市販されていない。Gad
c 1 はすり身の製造中に他の可溶性筋形質タンパク質と共にタラから除かれるようである105(すり身はゼラチン状の性質のある魚がすり潰され、徹底的に洗浄され調製される。)。しかしながら、他のタラ
アレルゲンはすり身に残っており、この製品は低アレルゲン性とはならない105。
食品製造に用いられるその他の加工の食物アレルゲン性に対する影響は評価されていない。均一化(homogenization)が牛乳タンパク質におけるアレルゲン性エピトープの効力が増加されるという説があるが、均一化は牛乳のアレルゲン性に顕著に影響しない117。ほとんどのアレルゲン性食物タンパク質は食品加工や調整中にそのアレルゲン性を保持しているようである。
E. 食品の低アレルゲン化処理へのアプローチ
研究開発の関心がなかったため、低アレルゲン性食品の調整は遅々として進まなかった。唯一広く商品化されている低アレルゲン食品は、調合乳に用いられる牛乳やダイズタンパク質に対するアレルギーの進行した患者向けのいくつかの特殊調製粉乳である。これらの低アレルゲン性特殊調製粉乳は徹底的に加水分解されたカゼインおよび/またはホエイを基にしている。タンパク質様(proteinaceous)アレルゲンはアミノ酸や非常に小さなペプチドに加水分解されているので、これらの調合乳はほとんどの牛乳アレルギーの乳児による摂取に対し比較的安全である。
ピーナッツ油のような、その他いくつかの食品は食品由来のアレルゲンが欠如しているため、低アレルゲン性を特徴づけられる可能性がある。しかしながら、これらの製品はこの方法で市販されておらず、調製毎に再現よくアレルゲンがないことを証明せずにこのアプローチをとることは賢明でないかもしれない。
IV. 用量反応関係
A. 感受性
特定のタンパク質にどの程度曝露されたら感作されるかはわからないが、IgE介在性食物アレルギーが既存する患者では極めて少量のアレルゲン性食物でもアレルギーが発現する。マスト細胞や好塩基球の膜表面における食物アレルゲンとIgE抗体の相互作用により、ヒスタミンやロイコトリエンなど、生物学的活性のあるアレルギー反応伝達物質が比較的大量に放出される。少量のアレルゲンとIgEの相互作用でも臨床的に重大な有害反応が発現することがある。万人に有害反応を誘発する食物アレルゲンの最小量を正確に算出することはできない。なぜならアレルゲン性食物に対する耐性は食物によって異なるし、個々人によっても異なるからである。
しかし、実際に発現したアレルギー反応を綿密に記録し、厳密な二重盲検対照方式によって行った食物負荷試験の結果を外挿すれば、各種アレルゲン性食物に対するほとんどの人の最小耐量は推定できるものと思われる。アレルゲン性食物の入ったパッケージを開封したり139、ピーナッツのカスが付着したカウンターやテーブルに接触したり140、調理中の食物から出る蒸気を吸ったり141、アレルゲン性食物を摂取した人の唇にキスしたりするなど141、偶然の接触によってアレルギー反応が発現することが逸話的に報告されている。時には極微量のアレルゲン性食物が混入していたために重度の反応が発現することもある。例えば、魚を揚げた油で揚げたフレンチフライで魚アレルギーの患者に致死的な反応が発現したことがある142。また、母乳しか与えていない乳児にピーナッツなどの食物に対する食物アレルギーが発現しており、これはアレルゲン性食物を摂取した母親から出る母乳に含まれる食物アレルゲンが原因だと思われる143-145。母乳によるアレルゲン性食物タンパク質の曝露量はかなり低いはずである。しかし、この場合、ほとんどの乳児は感作されても離乳期になってこのアレルゲンを大量に摂取するまで(アレルギー)反応は発現しない144。こうした経験や逸話から過敏ならごく少量の食物アレルゲンでもアレルギー反応が発現することがはっきりするが、最小耐量を推定することはできない。また、アレルギー反応の重症度は曝露量に直接関係するようである。従って、ごく少量のアレルゲン性食物ならほとんどの場合重度の反応を誘発することはないと思われる。
患者が摂取したアレルゲン性食物を定量的に記録すれば実際に発現したアレルギー反応から最小耐量を推定できる。SettipaneおよびSettipane146は、アレルギー患者では1〜2gのエビ、25mgのピーナッツによって有害反応が発現すると推定した。Gernら147はラベルの成分表示には牛乳の記載がない食物製品によって重度の牛乳アレルギー反応が発現した症例を調査した。原因のひとつとしてあげられたのはダイズを原料にした冷凍デザートで、乳製品の加工と同じ設備を使用したために(牛乳成分が)混入したものであった。この場合、一食に牛乳約2.5mL分が含まれていた147。2.5mLの牛乳には約80〜100mgの牛乳タンパク質が含まれ、そのうち80%はカゼイン、20%はホエイタンパク質である。そのほか、天然香料として部分的に加水分解したカゼインを含むホットドッグが原因の場合もあった。1本のホットドッグに含まれるカゼインは牛乳約0.3mL中のカゼイン量に相当しており147、この0.3mLの牛乳には約10〜12mgの牛乳タンパク質が含まれる。Jonesら148はラズベリーシャーベット製品によって発現した牛乳アレルギー反応を調査したが、これは加工工場で同じ設備を共用したために牛乳が混入していた。この牛乳アレルギー小児の場合、牛乳タンパク質を0.52%含むシャーベットを摂取(量は不明)したために反応が発現した148。また、ピーナッツバターを製造するのに使用した設備で加工したヒマワリバターが原因でピーナッツアレルギー患者にアレルギー反応が発現しており、この患者はピーナッツが約1%混入したヒマワリバターをティースプーンにして0.25杯弱摂取していた149。Ymanら150は、偶然または予期せずアレルゲン性食物を摂取してアレルギー反応が発現した過敏な症例について報告している。その多くは少量のアレルゲン性食物が原因で、具体的には0.04〜1.1%の牛乳が9件、0.003〜0.16%の卵が3件、0.3〜11.9%の小麦グルテンが3件、0.5〜7.0%のダイズタンパク質が3件、0.2%のヘーゼルナットが1件であった。このうちいくつかは曝露量に関する情報があった。牛乳アレルギー患者は成分表示されていなかったカゼインを0.06%含むソーセージを約100g(60mgのカゼイン)摂取して致死的アナフィラキシーが発現した150。また、ヘーゼルナットアレルギー患者は成分表示にされていなかったヘーゼルナットを0.2%含むチョコレート菓子製品を約3〜6g(6〜12mgのヘーゼルナット)摂取して喘息反応が発現した150。
最小耐量を最も正確に推定する方法は二重盲検食物負荷試験(DBPCFC)だと思われる。これまでこうした負荷が行われるのは診断のためであって、最小耐量を算出するためではなかった。標準的なプロトコールでは、まず患者に症状が発現すると推定される量の半分以下から開始する151。典型的な初期量としては400〜500mgが多いが152、初期量の選択には常に医師の判断が大きく影響する。事実、生命を脅かすアナフィラキシー反応が発現したことのある患者には盲検食物負荷を実施しない医師がいる152。従って、非常に過敏な患者はこうした最小耐量の推定の対象からは除外されていることがある。Atkinsら153は敏感な患者は100〜350mgの綿実粕タンパク質で有害反応が発現することを示している。Sampson140はDBPCFCで一部のアレルギー小児は50〜100mgのピーナッツタンパク質で有害反応が発現することを示している。Oppenheimerら154はピーナッツアレルギーを軽減する緊急免疫療法に関する先駆的な試験で、ピーナッツアレルギー患者は免疫療法の前に30mg〜8g、平均4gで有害反応が発現することを示しており、最小量は30mgであった。Oppenheimerら154は生命を脅かす症状が発現したことのある患者には脱脂ピーナッツ1mgからDBPCFCを開始した。他のピーナッツアレルギー患者には脱脂ピーナッツ100mgから開始した。通常、DBPCFCの上限はアレルゲン性食物8gである151。Oppenheimerら154の試験で、単回最大量は8gであったが、累積量は15.8〜15.9gに達した。確かに、数グラムのアレルゲン性食物を摂取しないと反応が発現しない食物アレルギー患者が多い。以上の経験からはっきり言えることは、ごく少量の食物アレルゲンでもアレルギー反応を誘発することがあるということである。敏感な患者ではミリグラム単位のアレルゲン性食物でアレルギー反応が発現している。最小耐量を確実に正確に推定することはできないが、既知のアレルゲン性タンパク質はなるべく摂取しないよう充分注意する。
B. 重症度は用量の関数
どの毒性反応もそうだが、アレルギー反応も用量反応関係を示し、その重症度は用量の関数である。皮内皮膚テスト(ST)で見られる用量反応関係がまさにそれである。食物アレルギーの場合これを裏づける証拠はほとんど観察に基づくもので逸話的である。繰り返しになるが、DBPCFCの経験から、いずれの患者も特定の時期に特定の閾値があり、その閾値に満たなければ臨床的に重大な反応は発現しない。先述したように、この閾値がかなり低い患者が多数いる。DBPCFCは有害反応が発現した最小の用量で中止する。ヒトが対象なので、いくらコントロールされた方法でもそれ以上の用量でさらに重症な反応が発現するのを確認するのは倫理的ではない。しかし、ほとんどの患者の場合、DBPCFCで経験する反応はかなり軽症で、より大量のアレルゲン性食物を摂取したものと思われる実際のアレルギー反応で発現する症状はより重症である。
C. 極微量曝露の源および発見
食物アレルギー反応を予防する第一の方法はその食物を避けた食事を摂ることである141, 155。アレルギー患者は極微量のアレルゲン性食物を摂取しても有害反応が発現するので、(アレルゲン性食物の)混入した食物が少量でもあればこの予防方法の成果は低減する。外食施設や加工食品施設での多くの個人摂取量から極微量のアレルゲン性食物が求められるが、多くのこのような状況は逸話的に記述されているに過ぎない。156。
個人レベルで極微量のアレルゲン性食物を摂取してしまうケースとしては、食べる前にアレルゲン性食物を除去しようとした場合、配膳器具や容器・調理用具を共用した場合、用具・容器・カウンタートップに触れた場合、アレルゲン性食物を触った場合、アレルゲン性食物を摂取した人の唇にキスした場合、アレルゲン性食物の入ったパッケージを開封した場合、調理中のアレルゲン性食物から出る蒸気を吸った場合、母乳によって食物アレルゲンが母から乳児に移行した場合などがあげられる。外食施設でアレルゲン性食物を摂取してしまうのは主にラベルに記載がないことが原因である。アレルギー患者が頼るのは給仕係や料理人がもたらす情報だが、得てして誤りがある。また、レストランで出される、チリにピーナッツバターを使ったような創作的な料理では、予期せずアレルゲン性食物を摂取してしまうことになる142。そうした場合、アレルギー患者は図らずもかなり大量のアレルゲン性食物を摂取することがある。さらに、外食施設では配膳器具や容器・フライパン・調理鍋を共用したり、2種類以上の食物を同じ油で揚げたり、テーブルの横で調理されている食物から出る蒸気を吸ったりするなどして、極微量のアレルゲン性食物を摂取してしまうことがある。また、食品加工施設でも他の食品が混入することがある。その場合、包装された食品のラベルにはそうした混入があることは記載されていないことが多い。そうした混入が起こりやすい食品加工業界の慣習としては、加工設備を共用する、再加工(ひとつの製品の残りを別の製品に添加)する、天然香料やスターチなどの成分にアレルゲン性タンパク質が含まれる、配合に誤りがある、異なる包装を使ったために表示が不適切である、成分を切り替えたのにラベルを変更していない、などがあげられる。
こうしたケースは少なからず起こっていると思われるが、明らかにされているのはごくわずかである。設備の共用による混入でアレルギー反応が発現した例がいくつかある147,
149, 157。ホットドッグの天然香料成分を酵母の自己分解物質から部分的に加水分解したカゼインに切り替えたためにアレルギー反応が発現したケースもある147。Porrasら137は、レシチンや油などダイズを原料とする成分にダイズタンパク質が含まれることを発見している。Ymanら150は、包装された食品に表示のないアレルゲン性成分が使用されたり、アイスクリームやパスタ、チョコレートの加工設備が共用されたり、スペルトパスタの表示が小麦無添加になっていたり(スペルトは実際には小麦の一種)、組成が変更になったのに表示が変更されていなかったり、香料や結合剤などの成分にアレルゲン性成分が含まれたりしているスウェーデン国内の例を数多く実証している。時にはハウスダストに含まれればアレルゲン性が高いDermatophagoides
farinaeダニがフリッターミックスに混入するといった、思いもよらないケースもある158。
免疫測定によって混入したアレルゲン性食物タンパク質残留物を検出することができる33。アレルゲン特異的IgE抗体が含まれるアレルギー患者の血清を使用するこの免疫測定はかなり信頼性が高い137,
147-149, 159。この免疫測定では本当のアレルゲンを検出できるが、アレルギー患者の血清に頼っているためいつどこでも利用できるというものではない。動物の抗血清やモノクローナル抗体を使った分析も成果を上げている150,
160, 161。こうした抗体によって必ずしも特異的にアレルゲン性タンパク質を検出できるわけではないが、かなり特異的に特定の食物タンパク質を検出できる。
V. 食物アレルゲンの試験および食物タンパク質のアレルゲン性
ヒトやヒトから採取したサンプルを使用する下記のin vitroおよびin vivo試験は、既に感作された患者に対するアレルゲン性しか調べられない。これらの試験によって新たなタンパク質の感作能力を予測することはできない。まだ完全に開発されたわけではないが、将来的にこうした評価の性能を改善するものとして期待できるのは動物モデルだけである。
A. In vitro試験
1. 免疫測定および抑制免疫測定
放射免疫測定(RIA)法やRIA抑制法についてはYungingerおよびAdolphson162が詳述している。RIA(図2)ではその食物のエキスを適当な固相に吸着させる。その食物にアレルギーを示す患者の血清をこの固相とインキュベートし、アレルゲン特異的IgE抗体を固相のアレルゲンと結合させる。それから125Iで標識した抗ヒトIgEを使ってアレルゲンと結合したIgE抗体を検出する。別の酵素免疫測定(ELISA)法では、酵素で標識した抗ヒトIgEを使用する。これらの免疫測定は食物アレルギー患者の血清が入手できるかどうかにかかっている。in
vivoと異なり、患者が試験にたち合う必要はない。
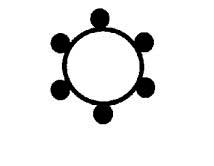 |
固相に吸着させた抗原(例、臭化シアン活性化セルロースに吸着させたピーナッツタンパク質) |
 |
固相に吸着させたタンパク質に結合する抗原特異的免疫グロブリン |
 |
標識抗ヒトIgEで検出される結合IgE |
図2. 食物特異的IgE抗体の放射免疫測定(RIA)
抑制法でも免疫測定と全く同様にその食物のエキスを固相に結合させる。様々な濃度の被検エキス(例、その食物を加工したもの)と食物アレルギー患者の血清を混合し、この混合物と固相をインキュベートして、被検エキスのIgE結合能力を調べる。固相と被検エキスが競合的にIgEと結合する。125Iで標識した抗ヒトIgEを使って固相に結合したIgEを測定する。固相に結合したIgE濃度と自由相すなわち被検エキスのタンパク質濃度をプロットして抑制曲線を作成する。抑制免疫測定を利用して、混入した極微量のアレルゲン性タンパク質残留物を検出したり147-149, 157, 159、加工がピーナッツやダイズを原料とする様々な食品のアレルゲン性にどう影響しているかを評価したりしている51, 54。
2. 二次元免疫電気泳動および放射免疫電気泳動
CIEやCRIEによって食物に含まれる様々なアレルゲンが分離・検出されている74, 163, 164。これらの方法にはいくつかの限界があり、ほとんどドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS-PAGE)に取って替わられているが、それでも一部のアレルゲンの検出には有用である。CIEやCRIEの一般的な方法についてはYungingerおよびAdolphsonが詳述している162。SDS-PAGEに比べ、CIEやCRIEで使用するアガロースゲルでは個々のタンパク質を識別しにくいことが大きな欠点である。
3. SDS-PAGEおよびイムノブロット
おそらくアレルゲンの分離・検出能力が最も高いのはSDS-PAGEと免疫ブロットを組み合わせた方法である。この方法を使って多数の食物に含まれる様々なアレルゲンが同定されている29,
43, 50, 60, 61。しかし、SDS-PAGEで発見された個々のIgE結合タンパク質の臨床的重大性は明らかにされておらず、あまり重要でないアレルゲンの場合特にそうである(「食物アレルゲン」を参照)。SDS-PAGEでは食物タンパク質エキスをSDSで処理して重合体タンパク質を最も単純な単量体サブユニットに分解する165。それからPAGEを使ってこれらのタンパク質を少しずつ異なる方法によって分離する。イムノブロットの方法については他で詳述している166,
167。分離したタンパク質を電気泳動によりニトロセルロースに結合させ、その食物エキスに対するIgE抗体を含むヒト血清をこのニトロセルロースとインキュベートする。酵素標識抗ヒトIgE抗体か放射標識抗ヒトIgE抗体のどちらか適当な方を使い、それぞれ比色酵素反応、オートラジオグラフィによって、IgE結合タンパク質を検出する。
B. In vivo試験
1. 皮膚テスト
おそらく食物アレルギーも含めてアレルギーの診断に最もよく使われるのは皮膚プリックテストである。通常、特定の食物の希釈エキス(1:10または1:20)を使って刺針/穿孔法によって行う。抗原投与後10〜30分以内に穿孔部位に希釈用対照の膨疹より直径が3mm以上大きい膨疹が発現したら陽性である。Bockら168が食物アレルギーを評価するための正しい皮膚刺針テストの方法を解説している。特定のタンパク質のアレルゲン性を評価する場合、通常、被検エキスは精製物質または半精製物質から調製する。皮膚テストの信頼性を高めるには、アレルゲンエキスを標準化するのが望ましい(John
A. Anderson著「食物に対するアレルギー反応」を参照)。
2. 負荷試験
DBPCFCは食物有害反応の診断におけるゴールデンスタンダードだと考えられている151。食物に対する有害反応の診断によく使われる(「食物に対するアレルギー反応」を参照)。食物タンパク質のアレルゲン性を調べるため、その食物に対して明らかにアレルギー反応を示し、皮膚テストまたは免疫測定が陽性の患者を選ぶ。反応が重症の患者は除外する。
DBPCFCでは食物をそのままの形では使用しない。通常、何らかの方法で乾燥させてから不透明で色つきのゼラチンカプセルに封入する151。多少の例外はあるものの、通常、1個のカプセルに入れる乾燥品の量は400〜500mgである。そのほか、Vivonexやミルクセーキなど液状ビークルに加える場合もある。また、ハンバーガーやアップルソースなど別の固形物に変えることもある151。どんなビークルを使うにしろ、もとの味が全くわからないようにする。カプセルは余分な食物を拭い取って粉末砂糖をまぶしつけ、均一に甘くすることが多い151。液状ビークルや固形ビークルでは、ビークルの味で被検物質の味をごまかす。液状ビークルの場合、グレープやチョコレートなど強い香料が好まれやすい。
通常、DBPCFCは広い範囲の用量で行う。初期量は過去の最小誘発量の1/2を超えてはならない。カプセル投与の場合、最大量は乾燥品にして8gだが、液状ビークルや固形ビークルを成人に投与する場合はもっと多い場合もある。
様々なプラセボがある151。当然ながら、液状ビークルや固形ビークルでは被検物質を加えないビークルがプラセボとなる。プラセボカプセルには砂糖やそのほか代謝されやすい成分が充填されていることが多い。オープン負荷や単盲検負荷よりDBPCFCの方がはるかに優れている。オープン負荷はDBPCFCが陰性だった場合の追跡検査として位置づけるべきで、通常に摂取する状態で反応が発現しないことを確認する。
VI. 遺伝子組換え食品のアレルゲン性評価における試験方法の活用
A. In vitro試験
1. 免疫測定および抑制免疫測定
遺伝子組換え食品の免疫測定では、新たに組み入れたまたは発現したタンパク質の精製品があればそれを固相に直接吸着させる。遺伝子組換え食品のエキスを固相に吸着させてもよい。この場合、実際に固相に吸着させたエキスに含まれる、新たに組み入れたまたは発現したタンパク質の量を測定する必要がある。エキスを調製する場合、後で皮膚テスト用エキスについて述べるように、新たに組み入れたまたは発現したタンパク質が抽出されるようにする。固相に吸着させる新たに組み入れたまたは発現したタンパク質の濃度は、ドナー食物を使った場合と同じようにするのが理想的である。
遺伝子組換え食品に含まれるアレルゲンを検出するには、患者を1ヶ所に集める必要のない免疫測定の方が皮膚テスト(第VI項B.
1を参照)より便利である。ドナー食物にあまりアレルゲン性がない場合特にこれは有利である。もちろん、血清は問題になっているドナー食物に対して明らかにアレルギー反応を示す患者から採取する。
免疫測定は遺伝子組換え食品のアレルゲン性を評価するのに有用だが、抑制免疫測定の方が有用性はさらに高い。抑制免疫測定ではドナー食物のタンパク質エキスを固相に吸着させる。遺伝子組換え食品からもエキスを調製するが、皮膚テスト用エキスについて述べる注意をすべて守って行う(第VI項B.
1を参照)。様々な濃度のこの遺伝子組換え食品エキスとそのドナー食物に対してアレルギーである患者のヒト血清を混合した後に、固相とともにインキュベートする。固相に結合したドナー食物のアレルゲンと自由相にある遺伝子組換え食品のアレルゲンが競合する。ここでもまた125Iで標識した抗ヒトIgEを使って固相に結合したIgEを測定する。固相に結合したIgE(%)と自由相のタンパク質濃度をプロットして抑制曲線を作成する。
栄養価を高めるためにダイズにコピーしたメチオニンが豊富なブラジルナッツのタンパク質にアレルゲン性のあることが抑制免疫測定によって判明した169。
2. SDS-PAGEおよびイムノブロット
SDS-PAGEとそれに続くイムノブロットを利用して、アレルゲン性であることが判明しているドナーから新たにタンパク質を加えた遺伝子組換え食品を分析することができる。実験ではホスト植物を原料とする食品やドナーを原料とする食品と遺伝子組換え食品を比較することができる。この3つの食品のIgE結合タンパク質を比較することによって、遺伝子組換え食品にドナー由来のアレルゲンが含まれるかどうか判定することができる。SDS-PAGEと免疫ブロットの組み合わせはかなり感度が高く、放射能標識した抗体とオートラジオグラフィを使用した場合特にそうである。従って、遺伝子組換え食品に発現したアレルゲンがたとえかなり少量でも検出される可能性が高い。この方法によって、含硫アミノ酸の欠乏を補正するためにダイズに導入したメチオニンが豊富なブラジルナッツのタンパク質が、ブラジルナッツのタンパク質の中でIgE結合能力が最も高いことが判明した169。
B. In vivo試験
ヒトを対象に遺伝子組換え食品のアレルゲン性を評価する場合は、いくつかの倫理問題を検討しなければならない。審査委員会(IRB)の承認を得る必要がある。
1. 皮膚テスト
ドナー物質がアレルゲン性食物を原料とする場合は、IgE抗体の反応性を調べる皮膚テストが遺伝子組換え食品のアレルゲン性を評価するのに有用である。どの評価でもドナー食物物質に対して明らかにアレルギー反応を示す患者を特定しなければならない(Dean
D. Metcalfe他著「遺伝子組換え植物を原料とする食品のアレルゲン性評価」を参照)。
皮膚プリック試験に使用するためには、遺伝子組換え食品のエキスを調製しなければならない。生の食物と加工した食物を比較するのが有用な場合もあるが、たいていは生の食物を使ってエキスを調製する。比較のためドナー食物や遺伝子組換えをしていないホスト食物も調製して試験対象に加えることもある。通常、皮膚プリック試験に使用するエキスは生の食物を粉砕し食塩水に加えて抽出する。その前に脂肪を取り除く食物もあるが、それは脂肪が多すぎて抽出の妨げになる場合だけである。この食塩水エキスにはその食物に含まれていた可溶性のアルブミンやグロブリンが含まれる。新たなタンパク質が食塩水に溶けにくいことがわかっている場合は、他の抽出方法を考える。エキスの調製が不必要な場合や賢明でない場合もたまにある。生の果物のエキスが極めて不安定であることは有名である。この場合、生の果汁を皮膚に落としたり、皮膚表面に果物やその他の食物を置いて針をその上から刺し皮膚に穿孔したりする方が望ましい。皮膚テスト用エキスに新たなタンパク質が含まれるかどうか確認し、測定する。食塩水エキスの希釈度は必要に応じて調整し、適切な濃度にする。食塩水エキスに含まれる新たなタンパク質が十分でない場合は、何らかの濃縮法を検討する。さらに、食塩水エキスにおけるそのタンパク質の安定性も調べる。タンパク質が不安定な場合は、試験ごとに新たなエキスを調製する。
2. 負荷試験
DBPCFCは、遺伝子組換え食品に導入された遺伝子物質をもともと含んでいた食物に対して明らかにアレルギー反応を示す患者を対象に行う(「遺伝子組換え植物を原料とする食品のアレルゲン性評価」を参照)。試験群の各患者のアレルギー状態は、有害反応の臨床的既往歴があるかどうか、DBPCFCでもともとの食物に対して陽性かどうか、皮膚テストで陽性かどうか、特異的IgE抗体による免疫測定で陽性かどうか、に基づいて確認する。
DBPCFCの前にまず遺伝子組換え食品のエキスを使ってST(皮膚テスト)および免疫測定を行う。皮膚テストでエキスに対して陽性だった場合、DBPCFCは特別に慎重に行う。
DBPCFC負荷に使用する食物は通常どおりに収穫・洗浄・加工する。負荷食物は通常期待されるすべての成分を含んだものでなければならない。たとえば、小麦を評価する場合、小麦粒は全粒小麦粉にする。(試料となる)製品の形態は反応を誘発すると疑われる形態でなければならない。油科種子の場合、ホールピーナッツだと油分が多く投与ビークルに加えるのが難しければ、粗びき粉と油を別々に調べる。ほとんどの食物は使いやすいよう投与前に乾燥させるが、生の食物が必要なDBPCFCもある。たとえば、果物に対するアレルギー反応は通常生の果物でしか起きないので、その場合被検物質としては生の果物が最もふさわしい。推奨用量はどのDBPCFCも同じである。また、精製組換えタンパク質をDBPCFCに使うこともあるが、ヒトへの負荷はIRBの承認が得られにくい。
遺伝子組換え食品のDBPCFCを実施する場合、プラセボは遺伝子を組み換えていない品種からつくった食品である。このプラセボは、新しく導入されたタンパク質を除けば、味、舌触り、組成とも遺伝子組換え食品と同じなので有用である。
C. 動物モデル
新たな動物モデルがあれば、遺伝子組換え植物を原料とする食物のアレルゲン性をどの程度評価できるかを検討することもできる。そうした食物アレルギーの動物モデルは理論的に満たさなければならない基準がいくつかある。第一に、被験動物はごく少数のアレルゲン性タンパク質に対しては著しいIgE抗体反応を示すが、通常曝露されるほとんどの食物タンパク質には耐性でなければならない。第二に、アレルゲンへの曝露および負荷は経口的に行われなければならない。第三に、このモデルは、食物によるアレルギー反応が、GI反応、皮膚過敏症、呼吸器過敏症など、ヒトと同じ器官に過敏症が発現するものでなければならない。最後に、そうしたモデルは比較的誘発しやすく、同じ種なら場所が異なっても期間をおいても常に再現性があるものでなければならない。残念ながらそうした動物モデルは今のところなく、近い将来も見込めそうにはない。そのかわりになるものと言えば、非経口接種したアレルゲン+アジュバントに対してアレルゲン特異的IgE抗体を産生する動物である170。こうしたモデルは食物アレルギーの研究やアレルゲン性の測定に有用ではあるが、適切な食物アレルギーモデルではない。
残念ながら現時点では正確に食物タンパク質のアレルゲン性を予測したり食物によるアレルギー反応を再現したりできる動物モデルはない。問題は、そうしたモデルは必然的に基準が厳しく、その上、動物モデルだけでは複雑な問題に答えを出すのが難しいということである。さらに、動物モデルには必ずしもどのIgE抗体反応も同一ではないという問題がある。マウスとラットではIgE抗体反応が異なるし171、同じマウスでも系統が異なれば異なる172,
173。しかし、これはヒトで見られるIgE反応の多様性を反映しているわけで、必ずしも欠点ではない。そのほか、実験動物の反応が常に一定ではないという問題もある。Kemeny171は、自身の研究室で同じアレルゲン、同じ免疫方法を使っても動物のIgE反応が1年前とは異なることを報告している。
マウス(最も研究が行われている)などの動物では、水酸化アルミニウム172や百日咳菌173などのアジュバントを使用しなければはっきりしたIgE抗体反応を得るのが非常に難しい。おそらく最も研究が行われているのは百日咳菌ワクチンであるが、この反応を引き起こす成分の特徴はまだ十分にわかっていない。もっと最近のことだが、Kemenyはトウゴマ毒リシンを使ってIgE抗体反応を引き起こした。この物質を使って、IgE抗体反応の調節にCD8+
T細胞が関与することを示した174。
動物モデルでもうひとつ考慮しなければならないのは、実験動物が経口摂取または胃内投与したアレルゲンに反応する必要があるということである。残念ながら、この経路での、特にアジュバントのないアレルゲンに対する動物の反応についてはほとんど情報がない。長年、動物を使って食物誘発性アレルギー反応を調べる研究が数多く行われている。Jarrett175は、経口的または注射によって抗原を投与したラットの反応を調べ、抗原によってその後のアレルゲン曝露に対するIgE反応が増強するどころか軽減したことを報告している。このラットは免疫調節機構によってIgE産生を抑制する能力を高度に備えている。ByarsおよびFerraresi176は興味深いラットの腸アナフィラキシーモデルを開発した。感作ラットにおける経口負荷による腸透過性の変化が、125Iで標識したBSAの取込みによって測定されている。そのほか、感作マウス177やウサギ過免疫モデル178における腸アナフィラキシー反応を使って、処理牛乳のアレルゲン性が未処理牛乳に比べて低いかどうかが検討されている。著者はこれらのモデルで有望な結果が得られたと報告しているが、これは他の低アレルゲン性調合乳の評価報告とは異なる。
Bozelkaら179は経口または胃内投与により2種類の食物アレルゲン(ダイズおよびエビ)でC3H/HeJマウスを免疫し食物アレルゲンモデルを作成しようと試みたが、めざましい成果は得られなかった。ダイズ、エビとも腹腔内投与した場合はアレルゲンに対して特異的なIgE抗体反応が発現したが、胃内投与した場合は百日咳菌アジュバントの併用に関わらずIgE抗体反応は発現しなかった。
食物アレルゲンのすべての動きを調べる動物モデルはない。タンパク質のIgE抗体反応誘発能力を評価する動物モデルならある程度期待できるが、まだ今後の研究が必要である。ヒトにおける特定の食物物質のアレルゲン性を予測するのに、動物モデルを過信してはならない。その悲惨な例として、ホエイの部分的加水分解によって低アレルゲン性の乳児用調合乳を開発しようとした試みが挙げられる76。IgG抗体反応を測定するウサギ動物モデルでこの製品の免疫原性が調べられた。このモデルでは免疫原性が低いと予測され、この製品は低アレルゲン性乳児用調合乳として発売された。しかし、実際にはこのホエイの部分加水分解産物にはかなりのアレルゲン性が残っており、牛乳アレルギーの乳児に与えるとアレルギー反応が発現した79,
80, 126。こうした動物モデルだけに基づいた研究の結果は慎重に解釈しなければならない。
VII. 要約
通常、食物アレルゲンは消化、酸、熱処理に耐えるタンパク質である。しかし、いくつか例外もある。既に感作された患者ではかなり少量(ミリグラム単位)の食物アレルゲンでアレルギー反応が発現する。アレルゲン性であることがわかっている食物源に由来する特定タンパク質のアレルゲン性は明らかにすることができるが、アレルゲン性が不明の食物源に由来するタンパク質のアレルゲン性は評価が難しい。







