1. 序論
遺伝子組換え技術による改良品種は、経済上最も重要な穀物を含めてすでに60種以上にのぼり、その数は増え続けている(第4章「食品蛋白質の遺伝子改変」表2参照)。これらの作物に導入された特性は、防虫、成熟遅延、ウィルス抵抗性、改良澱粉、除草剤耐性、改良オイル、病害抵抗性、雄性不稔等である(第4章)。今後4〜5年の間に20種以上の遺伝子組み換え作物を利用した製品が市場化されるものと予想される(第4章表3)。
市場導入に先立ち、これらの製品のそれぞれに食品、飼料、環境の視点から安全性評価が行われる。この章では食品の安全性評価の一つとして、遺伝子組換え作物を利用した食品の潜在的アレルゲン性評価に関する代表的な意見と、科学的な評価手法について述べる。遺伝子組み換え穀物に導入される特性の大部分は、わずか2〜3の新規タンパク質が発現した結果生じる。また、逆にある遺伝子の働きを止めるための遺伝子を導入して目的の形質を得る場合もあり(アンチセンス、コ・サプレッションなど)この場合作物中に導入されるのはマーカータンパク質のみである。一般的にこれらのタンパク質の発現量はわずかであり、その植物体の全タンパク質に占める割合も少ない。対照的に、ある一つの植物体では数万種類の蛋白質が発現し、そのいくつかは高濃度に存在する(第4章)。その膨大な多様性にも拘わらず、アレルギーを引き起こすタンパク質はそのうちの1−2%にも満たない(第2章)。食品アレルギー患者はたいていの場合、ほんの数種の食品に含まれているわずか2、3種類の特定のタンパク質に対しアレルギーを起こすのである。
世界で報告されている食品アレルギーの90%以上は、8種の食品(群)、つまりピーナッツ、大豆、木の実、ミルク、卵、魚、甲殻類、小麦によって引き起こされている(第5章「アレルギー食品」表1)。この表は、FAOの後援で最近開催された、食品アレルギーに関する専門家会議での議論をもとに作成されたものである。報告されている食品に対する免疫反応事例の大多数はイムノグロブリンE(IgE)仲介型の過敏性反応で、これは急性で過激な反応をおこして生命の危険があるため一般的な関心も高い。ほかにも食品タンパクが誘発する過敏性反応は存在するが(第2章「食品に対するアレルギー反応」)、免疫反応を誘発するタンパク質の導入の有無を知るにはIgE仲介型の免疫反応を調べるのが最も確実であり、したがって本章ではほかの免疫反応については特に考慮していない。たとえば、グルテン過敏性腸症(セリアック症)はある種の食物のグルテンに感受性が高い人にみられる臨床学的に特異な症例であるが、本章では特に取り上げないし、逆に本章で述べる評価手法はセリアック病の場合には適当でない。
遺伝子組換え作物を用いた食品の潜在的アレルゲン性評価法としては、多面的な分析を通じて評価を行う方法を提案する。ここで検討されるのは、遺伝子の由来、既知アレルゲンとのアミノ酸配列の比較、in
vitroおよびin vivo での免疫学的分析、さらに物理化学的特性についての評価である。
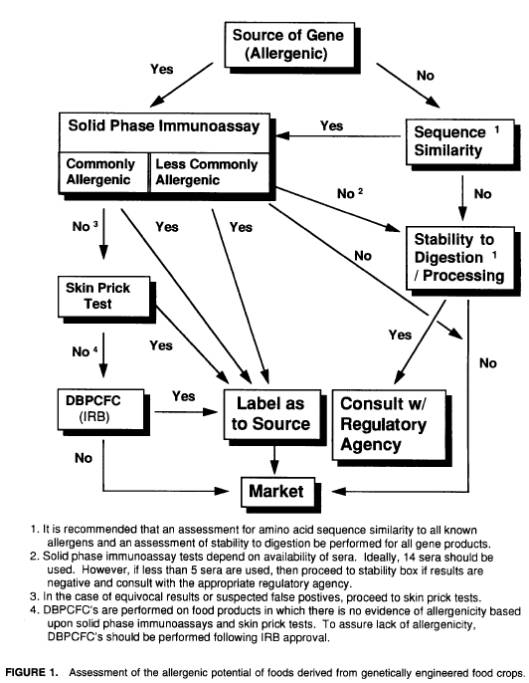
判断樹(図1)にしたがって適切な対応を選びながら、慎重に段階を踏んで作業を進めていけば、合理的に潜在的アレルゲン性の評価を行うことができる。これらを総合的に評価することにより、新品種の作物に由来する食品について、既存の同等品以上にアレルギーを懸念しなくてよいことが保証される。万一アレルゲンが導入された場合、その食品は適切な表示がなされ、したがって感受性の高い消費者はその製品を避けることができる。
以下判断樹アプローチについて、適当に例を挙げながら説明する。
2.導入遺伝子の素材
米国食品医薬品局(FDA)は食物アレルゲンが遺伝子と共に導入される可能性を検討すべきと考え、「新しい植物種に由来する食品」に関する政策の中で次のように述べている。「(アレルゲン性を持つ素材から遺伝子を得た場合)FDAでは、生産者は慎重を期して、導入蛋白質がアレルゲンであるとまず仮定すべきであると考える。適当なin
vitroあるいはin
vivoでのアレルギー試験によって、潜在的に感受性の高い人々(例えば、その蛋白質が通常見いだされる食品に対して感受性の高い人々など)が新品種を用いた食品にアレルギーを起こすかどうかを調べることができるだろう。」さらにFDAは以下のように述べている。「既知の、あるいは予期されるアレルゲンを新規に含んでいる食品には、その可能性を消費者に知らせる表示が必要かもしれない。」その表示にはその遺伝子が由来した素材を明示すべきである
* 。
潜在的アレルゲン性を評価する上で、その遺伝子が何から得られたのかは非常に重要なパラメーターとなる。それが既知アレルゲンを持つ素材であればアレルゲン蛋白質をコードしている遺伝子が導入されていないか確認する必要性が生じ、導入されている場合は表示が義務づけられる。
既知のアレルギー素材から導入した遺伝子のコードしている蛋白質が新しい植物種を利用した食品の成分の中に発現している場合、それがアレルゲンでないことを確認するためのデータが必要である。ただしその遺伝子が、本来の生物の中では通常ヒトが消化系や呼吸系を通じた暴露を受けない部位に発現しているものならば(例えば大豆の根やピーナッツの葉など)、その遺伝子がアレルギー素材に由来していることを考慮する必要はない。また、既知のアレルゲンが導入されてもそれが通常食品として消費されない部位に限定的に発現している場合には、遺伝子の発現と蛋白質産物の蓄積が植物の非可食部位に限られているということを証明できればアレルギーの危険性がないと結論してよい。
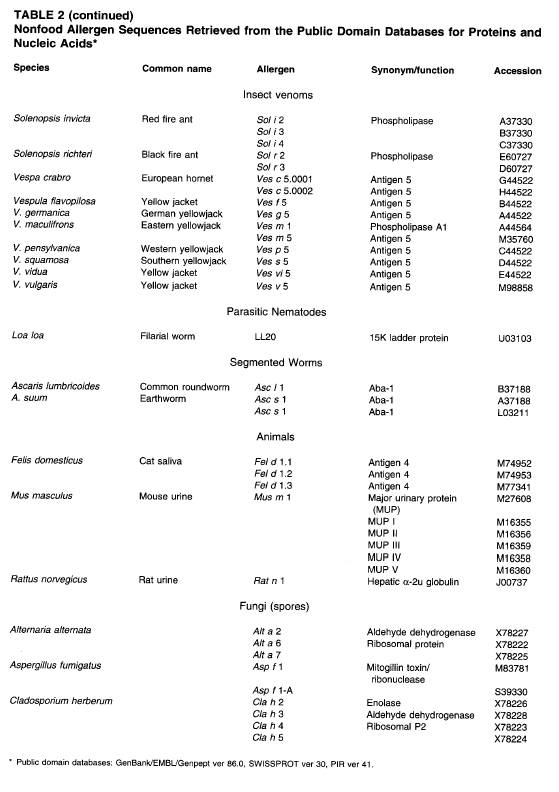
導入遺伝子の素材の評価では次の3つを区別することが重要である。:a)一般的なアレルギー食品。b)非一般的なアレルギー食品とその他(食品以外)の既知のアレルゲン素材。c)アレルギー歴のない素材。本章では「一般的なアレルギー食品」を前述した8つの食品(群)と定義する。(これらは第5章「アレルギー食品」表1にも載せた。)これまで報告されている食物アレルギーの90%以上はこれらの食品が原因であり、後述する評価方法に必要な患者血清などの臨床試験用試料が入手できる可能性も高い。しかし他の食品群、例えば魚や木の実のある特定の種(めかじきやブラジルナッツなど)などでは事情が違うと思われる。第5章
表2に一般的ではないアレルギー食品を示したが、これらの臨床試験用試料の入手は、花粉、かび、毛、毒など食品以外のアレルギー素材同様、あまり容易ではないと思われる。

一般的、非一般的アレルギー食品(群)はともに、主要アレルゲンと非主要アレルゲンの両方を含んでいる。主要アレルゲンと非主要アレルゲンは、ある特定の食品に対する臨床反応にそのアレルゲンがどのくらいの頻度で関与したかによって分類される。主要アレルゲンとは、皮膚テスト(ST)または固相イムノアッセイにおいて、ある物質に感受性の高い人の50%以上が反応するものと定義される。ここでいう「感受性が高い」とは、症状の記録や検査の結果に、典型的な即時型過敏反応の徴候もしくは症状がみられることを指す。アレルゲンに関する関心の大部分は、一般的・非一般的アレルギー食品(群)ともに主要アレルゲンに集中している。なぜなら、例えばピーナッツ感受性のすべての患者はピーナッツの一方あるいは両方の主要アレルゲンに反応するが、非主要アレルゲンについてはその臨床上の重要性がほとんどわかっていないからである。
*
以前からFDAでは、ある食品と食品添加物が一部の消費者に与えうるリスクは回避可能であるという認識を持っている。こうした場合FDAでは一貫して、感受性の高い人々がアレルギーを起こしうる食品・原料が含まれている旨を企業が自主表示するのに一任してきた。例えば、亜硫酸剤(21
C. F. R. § 101.100 (a) (4))やD&C黄色5号(21 C. F. R. § 74.705 (d)
(2))のような着色剤などがその例である。またその他の例では、食品の天然成分の1つであるグルテンがある。FDAでは利用されているグルテンが、とうもろこしグルテン(21
C. F. R. § 184.1321)か小麦グルテンか(21 C. F. R. §
184.1322)区別することを要求している。なぜなら、セリアック病患者は小麦由来のグルテンを摂取した場合は必ず腸の不調を起こすが、とうもろこし由来のグルテンは問題なく食べることができるからである。それぞれの場合において、表示により必要な情報を開示して消費者にその原材料に関する警告を与えれば、消費者はそれらに暴露される危険を回避することができる。このように食品の表示を利用すれば、大多数の人々には安全な食品が一部の人々に与えるリスクをなくすことができる。ここで特記すべき点は、FDAが表示義務を課すのは、科学が理論的にアレルギーの危険性が実在することを立証した場合に限られるということある。
こうした状況において、製品表示による情報開示が信頼できる健全な社会的メカニズムであり、消費者が食品を賢く選ぶことを可能にする効果と価値のある方法であることが証明されてきた。表示は、科学的根拠のある方法に従って行われれば、消費者への情報提供・指示・警告がその目的にかなった役割を果たすことができる。
FDAはまた、食品表示情報に対する消費者の理解と利用なしにはこうした目的が達成され得ないことも認識している。そのため同局では表示内容を、表示対象食品・原材料の特定と質に関して本質的な情報だけに限定している。
表示情報の実際の正当性を慎重に検討する試みは、法的・科学的な必要性に加え、バイオテクノロジーによる植物を用いた製品に表示をしようとする場合に必ず伴うであろう非常に現実的な問題の数々に対応するためにも必要である。ほとんどの消費者にとって、これらの製品は代替のきく穀物製品である。市場でこれらバイオテクノロジーに基づく商品と伝統的育種技術に基づく商品とを区別することは、収穫・輸送・貯蔵・加工の点で、コスト的にも手間の面でも非常に非現実的である。そのうえ、製品のあるタイプのものを他のものと区別する決定的手法が開発される見込みがない。
3. 既知アレルゲン蛋白質とのアミノ酸配列の類似性
食品の潜在的アレルゲン性の評価はいかなる素材から遺伝子を導入した場合でも、導入蛋白質のアミノ酸配列を既知アレルゲンと比較することから始められる。アレルゲンとなる素材には、ある種の植物や動物に由来する食品が含まれ(第5章
表1、表2)、さらに花粉・かびの胞子・昆虫の毒や糞・動物の毛や尿のような、非食品アレルゲンも考慮する必要がある。これらの蛋白質に対する感受性が経口、経皮、あるいは呼吸系を通じた暴露によりすでに高まっていれば、遺伝子組換えによりそれらを導入した食品を摂取した場合やはり反応を起こす可能性があるからである。呼吸系や皮膚を通じて感作するアレルゲンの多くは環境中や胃腸内では不安定であり、それらを経口摂取しても感作されることはないように思われる。しかし、経口性アレルギー症候群(OAS)のように、口腔内の限られた暴露であっても局所的に症状が引き起こされうることを示唆する例も知られている。
酵素から細胞骨格の調節因子まで、生体内でのアレルゲン蛋白質の機能は多様であり、それをもとにアレルゲン性の予測をすることはできない。したがって食品アレルゲンを含め、多くの主なアレルギー素材のアレルゲンについて、これまで分子生物学的な特徴解析が行われている(6章「食品アレルゲンの原則と特徴」参照)。いくつかのアレルゲンの重要なIgE
、T細胞、B細胞エピトープは既にマッピングされている。アトピーの免疫学的な発症メカニズムは、疾病によるものではない反応の場合とは異なると思われるがまだはっきりわかっていない。しかしながらマッピング研究によって、T細胞のエピトープではペプチドの長さがアミノ酸残基数8−12の場合が結合に最適であり、B細胞エピトープではそれより幾分長いらしいことがわかってきた。
こうした知見から、免疫学的な同一性があるためには少なくとも連続する8つのアミノ酸が一致する事が必要であると考えられ、これに基づき導入蛋白質と既知のアレルゲンのアミノ酸配列の比較テストを行うことが可能になる。ただしここでいう同一性のレベルは、生物学的な意味で関連性(相同性)のある蛋白質の場合の類似性に比べて、はるかに低い。アミノ酸配列の比較基準は、今後の研究でアレルゲンの構造に関する理解が進むにつれて変化し、さらに優れたものになっていくと思われる。今のところ、エピトープのアミノ酸配列がわかっているアレルゲンは全体から見ればほんのわずかにすぎず、特に食品アレルゲンについてはほとんど知られていない。しかし、現段階ではアレルゲンエピトープの包括的なデータはなく、既知アレルゲン自体についても配列の同一性の確認がなされていないことを考えれば、今回提案した方法は妥当である。むしろここで確認しておくべき事は同一性が存在する可能性の有無であり、アミノ酸配列中どこにも連続する8アミノ酸残基の一致がみられなければ、導入蛋白質が既知アレルゲンと共通の直鎖状エピトープを持つ可能性がほとんどないということになる。
生物学的相同性の高い別種の花粉で、アレルゲンのエピトープにまったく同じアミノ酸配列が保存されているのが時折観察される。アレルゲン間で IgE
の交叉反応が起こる理由はこれによって説明できる。さらに保存性の高いアミノ酸が、合成や部位特異的な突然変異によって置換された場合にIgEの結合性が低下することからも、エピトープのアミノ酸配列の重要性が示唆される。
しかし明らかにこの方法には限界がある。なぜならば、アレルゲンの三次構造に依存して立体的に構造化されるような、一次配列上は不連続なエピトープ(第7章「食品アレルゲン」)は認識できないからである。例えば、患者の血清中の
IgE とカバの木の花粉アレルゲンBet v 3の結合は、カルシウムによる立体構造変化に依存する。Bet v
3にはカルシウムと結合するEFハンド構造があり、おそらく、カルシウムの存在下で構造を変化させることによって立体エピトープの認識が可能になったのだと思われる。またこの方法によって同定されるアミノ酸配列が、単に一次構造の保存性が高いだけで蛋白質のアレルゲン性とは関係がないという場合も考えられる。以上のことからこの方法は、潜在的アレルゲン性を決定するためではなく、その可能性を示唆する指標として用いられるべきである。上記の試験基準に従い、FASTAや同様のコンピュータープログラムを使って公的な領域遺伝学のデータベース(GenBank,
EMBL, PIR
及びSwissProt)に登録されているアレルゲンのアミノ酸配列を検索し、遺伝子改変植物にそれと一致する配列がないかの確認を行う。アレルゲン蛋白質のアミノ酸配列を入手して検索する場合、情報を適切に検索するにはその検索方法が非常に重要である。“アレルゲン”といったキーワードをもとにアレルゲンのリストを探すだけの検索では、関連する全ての食物アレルゲンを検索することができず、また、アレルゲンでない蛋白質を検索してしまう可鉢もある。例えば、カゼイン、β—ラクトグロブリン、オボムコイドのような多くの食物アレルゲンは、“アレルゲン”というキーワードでは検索されてこない。このデータベースは、食物アレルゲンだけでなくすべてのアレルゲン蛋白質のアミノ酸配列を含有すべきである。表1と表2は、今まで報告されているアミノ酸配列に関する最もわかりやすいリストである。食物アレルゲン(表1)と非食物アレルゲン(表2)を包括しており、使いやすいように受入番号が付与されている。これらの表は1995年5月に作られたもので、さらに新しいアレルゲン蛋白質のアミノ酸や塩基配列が報告されたときには、常にそれらが追加されるようになっている。
このアレルゲンの配列のデータベース(または他の同様なデータベース)を用いて、いくつかの遺伝子組換植物で発現された蛋白質について検索した結果を表3に示す。これらの蛋白質には何ら有意な同一性はみられず、したがって、これらの導入蛋白質は、いづれも既知のアレルゲン蛋白質と同じ一次配列を持つIgEエピトープを持たないことが結論された。
判断樹では、導入遺伝子の素材に続いてアミノ酸配列の相同性分析を行った結果に問題がない場合、別の評価にさらに進むことになる(図1)。
4.一般的なアレルギー食品由来の遺伝子を有する食品
通常にアレルゲン性を示す食物由来の遺伝子を有する食品は、アミノ酸配列解析から得られる情報には関係なく、アレルゲン性の免疫学的な解析にかけるべきである。そして
in vitro アッセイと in vivo
アッセイの両方が用いられるべきである。これらのアッセイには、RAST法、RAST阻害法[31,32]、ELISA法[33]が含まれる。免疫ブロッティングの結果が陽性の場合は、RASTやELISAは不要であろうが、陰性の場合は、検出感度を上げるためにRASTまたはELISAが必要であろう。RASTやELISAを用いると、確実なアレルギー患者から5検体の正常血清を試験することによって、97%信頼度のデータが得られる。

RASTとELISAアッセイ(各々の詳細については6章で述べる)には、その遺伝子が由来する食物に対してアレルギー性を示すことが確認されている個体から得られた血清のIgE画分を使用する。血清供与者は、二重盲検でプラセボコントロールの食品チャレンジテスト(DBPCFC)で陽性である事を含め、厳重な臨床的基準に合致する[31、34]かまたは、重篤な、IgEに媒介される全身性反応の納得性のある経歴を持たなければならない[35]。納得性のある経歴には、一回の抗原刺激に伴う、医学的治療を要するような即時過敏反応の存在と、それが医師の記録に載っているという事実が必要であろう。これらの
in vitro
アッセイの一つまたはそれ以上から得られたデータは、導入された遺伝子がアレルゲンをコードしているかどうかについての強力な証拠となる。少なくとも5人の、確かな血清供与者を、個別に試験しなければならない。この
in vitro
テストの結果、97%の信頼限界外で陽性の結果がでた場合は、その遺伝子産物を含む食品すべてについて、FDAの指導[6]により、移入された遺伝子の起源を示しておかなければならない(図—8.1)。
もしその in vitro
テストの結果が陰性であったり、はっきりしなかったり、非特異的な交叉反応の疑いがある場合は、それ以上アレルゲン性の有無を追求するために皮膚プリックテスト[31]を行うべきである。皮膚テストのタイプや抽出物の品質を確保する必要性またそれらのテストに用いられる基準についての詳細説明は重要であり、6章で述べられている。少なくとも5人の、問題となっているもとの食品に対する皮膚テストが陽性であり、かつ、感受性に関して説得力のある経歴を持つ患者が試験されねばならない。この
in vitro テストで陽性の結果が出た場合は、 in vitro
テストで陽性の場合と同様に、移入された遺伝子の起源を明示しておくことが必要となる(図—8.1)。
in vitro
テストにおいても、皮膚プリックテスト(刺傷または刺孔)においても、ともに陽性の結果が得られなかった場合は、最終テストとして、問題となる食品に感受性の患者を使い、コントロールされた臨床的条件下で、二重盲検プラセボコントロールテスト(DBPCFC)を実施することになるであろう。このようなタイプの評価に対する倫理的配慮としては、テスト被験者における、アナフィラキシーショック誘発の可能性や、適切な臨床的安全性のデータや手続きが得られるか否かのような要因が含まれるが、そのような要因のみに限定されるものではない。すべてとはいわないまでも、DBPCFCを実施しているほとんどの研究機関では、すべてのDBPCFCを倫理的配慮の観点から検閲する研究機関検閲委員会(IRBs)を有している。これには、被験者にとって、そのテストを行うリスクが、該当する感受性についての通常の評価を行う際に起こりうるリスク以上にならないか否かの判断も含まれている。被験者に対するリスクを最小限に抑えるために、
in vitro
アッセイと皮膚テストによるデータをあらかじめ得ておくことが、DBPCFC試験を要求するために前もって必要である。第6章に、想定投与量や事前の注意を含む、DBPCFCを行うための詳細が述べられている。DBPCFCで試験された最低14人の感受性個体の中で、一人の感受性患者に陽性反応が認められた場合には、その蛋白質を含む作物由来の食品について、移入遺伝子の起源を明示しておかねばならない。
これら三段階の評価のいずれにおいても陽性反応が見られなかった場合は、この、通常にアレルゲン性を示す食品から得られた遺伝子は、アレルゲン蛋白質をコードしていないことが結論される。
この評価方法の有効性を示す例としては、動物の餌用大豆粉の含硫アミノ酸含量を高くして、品種を改良する目的で大豆に導入されたブラジルナッツの2S
貯蔵蛋白質の例が挙げられる。ブラジルナッツの2S蛋白質は大豆中で発現し、その組換え大豆の種子蛋白質全体の中で、かなりの比率を占めていた[39,
40]。ブラジルナッツは、少数の感受性個体において、アナフィラキシー反応を引き起こす事が知られている[41,
42]。ブラジルナッツ由来のアレルゲン蛋白質が大豆に移入されているかどうかを評価するためにRAST法が免疫ブロッティングと組み合わせて使用された[40,
43]。9人のブラジルナッツに感受性の個体のうち、8人の血清がRAST法で陽性を示した。この結果は、ブラジルナッツから得られた遺伝子が、ブラジルナッツの主たるアレルゲンをコードしている事を示していた。もし、万が一、この遺伝子を含む大豆製品が販売されるようなことがあった場合は、この大豆品種由来の大豆製品を含むすべての食品には、“ブラジルナッツ由来の蛋白質を含んでいる”旨を、明示しなければならないであろう。この例は、遺伝子の組換えによる既知のアレルゲン蛋白質の移入を同定する手段として、
in vitro アッセイを使用することの価値と有効性を示している。
5.一般的でないアレルギー食品またはアレルゲンを持つことが知られるその他の素材に由来する遺伝子を導入された食品
一般的でないアレルギー食品またはアレルゲンを持つことが知られるその他の素材に由来する遺伝子を導入された食品の場合、アミノ酸配列の分析とは別に、起こりうるアレルギーの可能性について免疫学的分析を行うべきである。分析方法としては in vitro アッセイが適当である。検査は、それに関するアレルギーを起こした記録のあるアレルギー患者の血清が入手しやすい場合、14人分以上の血清を用いることが望ましいが(ブタクサの場合など)、それが難しい場合は可能な限り多数の血清を入手して分析を行う(トウモロコシなど)。入手できる血清が5人分未満の場合は、規制を担当する適当な公的機関の助言を受けるべきである。またその場合、物理化学的性質についての検討も併せて行う必要がある(詳細は後述)。FDAガイドラインでは、免疫学的分析でわずかでも陽性と判断されたものがあれば(信頼度95%以上)、その蛋白質を含む食品には全て導入遺伝子についての表示を付すべきであり(図1)、一方、最低5人以上の血清を用いた検査ですべての結果が陰性であれば表示の必要はないとしている。
アレルギー食品としてあまり知られていない食物やアレルゲンを持つことが知られるその他の素材から導入された遺伝子生産物を評価するとき、固相イムノアッセイが5人未満の血清でしか行われず、かつその全てが陰性の場合には、その蛋白質についての物理化学的分析を行う必要がある。方法としては、導入蛋白質を既知のアレルゲン蛋白質と物理化学的・生物学的に比較することでその潜在的アレルゲン性を予見する方法が採られている。しかしこの方法は、アレルギー性を持つ素材から由来する既知のアレルゲンを同定するには有効であるが、これだけで遺伝子生産物の潜在的アレルギーの可能性を決定することはできないように思われる。
食品蛋白質がアレルゲンとなる前提として、消化器系内で安定なことがあげられる。(例えばヒト消化系において、蛋白質分解酵素の影響を受け難く、酸性環境下でも安定である。)またほとんどの場合、特殊な食品に用いられる加工処理(熱変性に対する耐性)に対しても相対的に耐性が高いことも重要である。たとえばピーナッツや大豆のアレルゲンがピーナッツバターや黄粉に加工される工程を経てもそのアレルゲン性を失わないことなどがその一例であり、導入蛋白質の潜在的アレルゲン性の評価においては、そうした易消化性や加工処理中の安定性についても検討しておく必要がある。なお例外として、口腔内アレルギー症候群(OAS)で消化器系での安定性が低い蛋白質がアレルゲンとなるケースがあるが、この場合全身的なアレルギー症状に至ることは少ない。
また、このほかのアレルゲン蛋白質の特徴として、分子量 10-70kDa のものが多いことや、グリコシル化されている場合が多いことも挙げられるが、これらの性質は非アレルゲン蛋白質にも該当することが多く、またアレルゲン蛋白質でもその例外となることが少なくないため、判断樹による評価においてはこれらの項目は採用していない。
A.易消化性
アレルギーが起こったということは、まずアレルゲンが腸管粘膜に到達し、そこを通り抜けたということである。もともと蛋白質そのものは腸管粘膜から体内の循環系に侵入することができる[48]。

酵素分解されにくく消化管内で安定な蛋白質ほど腸管粘膜に到達する可能性が大きいことは明白であり、まだ直接試験されていないものも多いが、実際多くのアレルゲンが蛋白質分解酵素に対し耐性を示すことが知られている(「食品アレルゲンの条件と特徴」の章を参照)。
植物への導入蛋白質を一般に知られる多数のアレルゲン[58]と比較するには、アメリカ薬局方[57]の記載と同様、哺乳類消化器系の胃−腸モデルが用いられている。これらは、動物[61]・植物性[59,60]蛋白質や食品添加物[62]の消化性の検討の際にも用いられており、牛乳のアレルゲン[63,64]の安定性試験にもこれと類似したモデルが使用されている。
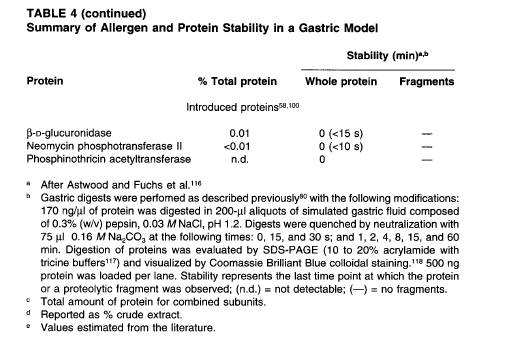
一般的なアレルゲンについてその易消化性を検討した研究結果の一例を表4に示す。これらのアレルゲンは例外なく胃−腸消化器系(GI)モデルによる試験[58]で高い安定性を示し、アレルゲン自体もしくは蛋白質分解されたその断片は人工胃液中で最低2分間以上安定して存在した。また、主要なアレルゲンの多くは1時間以上安定であった。
安定性に関する同様のデータは、相対的な安定性に関する評価はまったく同じではないが、他の研究からも報告されている[65,66]。これらアレルゲン蛋白質と比較すると、非アレルゲン性蛋白質は同じ条件下で速やかに分解される。表4に示された8種類の非アレルゲン性蛋白質は初めのわずか15秒で分解されてしまっている。
蛋白質が速やかに分解されればされるほどそれが腸管粘膜から吸収される可能性は小さくなる、つまりそれがアレルギーを引き起こす可能性も少なくなるはずである。ヒトの消化器系に、蛋白質が腸管粘膜に到達する前にそれを除去するしくみが備わっていることから考えて、人工消化器系モデルはアレルゲン性評価の有効な手段であるといえる。
B.加工処理に対する安定性
種々の加工処理に対する安定性もまた、導入蛋白質のアレルゲン性を評価する上で重要である。加工後も素材のアレルゲン性を保持しているピーナッツや大豆製品の例から、食品アレルゲンは、加工食品にも含まれるようなものは特に、加工に対して安定である傾向があることが予想される(「食品アレルゲンの条件と特徴」の章を参照)。この点についての検討は、遺伝子を導入した作物がトマト・柑橘類・レタスなど生食用である場合には不要であるが、大豆・小麦・コメなど、消費者の口に入るまでに何段階かの加工工程を経るような場合はそのアレルゲンの加工安定性を考慮するための適当な試験が実施されるべきである。ただし、ヒトが消費する最終製品に蛋白質が含まれていない場合は消費者が著しくその導入蛋白質に暴露されることがないため、アレルギー発症の可能性は大幅に低減されるか除去される(油脂や炭水化物など)。被験者数が限定された食品の摂取実験で、大豆・ピーナッツ・ひまわりなどを含む数種の作物から搾取した油をそのアレルギー患者に与えてもアレルギー反応は見られなかったという報告があるが、加熱処理された植物油中に含まれる蛋白質量は極めて微量もしくは無視できる量であるため、この結果は驚くにあたらない。
導入蛋白質が、一般的でないアレルギー食品またはアレルゲンを持つことが知られるその他の素材に由来する場合、それが消化器系内で非常に不安定である、もしくは加工処理によって大幅に分解・除去されるならば(その作物が全て加工される場合)、導入遺伝子についての表示は必要でない。しかし加工および(または)消化に対し耐性がある場合は、規制を担当する適当な公的機関の助言を受けるべきである。
6.アレルギーの症例が知られていない素材から遺伝子を導入した食品
アレルギーの症例が知られていない素材から遺伝子を導入した場合、3章で述べた通り、その導入蛋白質と既知アレルゲンのアミノ酸配列について比較を行う。もしあるアレルゲンとの相同性が高く、そのアレルゲンに対するアレルギー患者の血清が入手可能ならば、導入蛋白質についての固相イムノアッセイによる免疫学的評価を行うべきである。その手順は、前章「一般的でないアレルギー食品またはアレルゲンを持つことが知られるその他の素材に由来する遺伝子を導入された食品」で述べた方法と同様である。
一方、著しいアミノ酸相同性が認められなければ、V.A.章およびB章で記述したように、易消化性と安定性についての評価を行う。この場合、導入蛋白質が速やかに分解または加工過程で除去されるならば食品に導入された遺伝子についての表示は必要ではない。例えば表3はさまざまな遺伝子組換え作物に導入された9種類の蛋白質のアミノ酸配列であるが、これらはいづれも既知アレルゲンとの相同性がなく、前述した易消化性についても速やかに分解されることが確認されている(表4)。こうしたデータに基づき、これらの蛋白質が導入された商品は導入遺伝子に関する表示がされずに市場に出ることになるだろう。
7.その他の検討事項
A. 導入蛋白質が食品中に占める割合
食品アレルゲンはしばしばその食品における主要蛋白質として存在し、全蛋白質量の1-
80%を占める場合が多い。一般的なアレルギー食品の場合は特にその傾向が強く、表4に示すように、牛乳、大豆、ピーナッツなどはアレルゲン含有量の多い食品の例として挙げられる。このことから、ある蛋白質がその食品中で全蛋白質量の1%を超えるレベルで発現している場合には、やはりアレルゲン性評価を行う必要があると考えるべきだろう。表4に示したアレルゲン蛋白質の多くは全蛋白質量に占める割合が1%未満であるが、それと比べて市場導入を目的として開発された遺伝子組換え作物(表3)の場合、その導入蛋白質が未加工製品に占める割合は湿重量で.0001%以下から0.03%で、これは総蛋白質量の0.01%以下から0.4%にすぎないため、この点に関する心配はないといえる。
B. 宿主
ある食品にアレルギーを起こす消費者は、その遺伝子組換え体を利用した食品も同じように避けると予想されるが(大豆、ピーナッツなど)、これまでその食品にアレルギーを起こさなかった人でも、その作物の固有アレルゲンが不注意な遺伝子操作により顕著に増加すればアレルギーを起こすようになる可能性がある。したがって、遺伝子組換えで宿主となる作物にアレルゲンが含まれていることが知られている場合、そのアレルギー患者の血清が入手可能ならば、組換え体を利用した食品についてその宿主に含まれていたアレルゲン量が自然に生じる固体差のレベルを超えて増加していないことを確認すべきである。ただし、大豆など一般的なアレルギー食品が宿主となる場合はその確認が不要である場合も考えられる。というのは、遺伝子操作により改変される性質は限定的であるべきであり、例えば、大豆にアンチセンス遺伝子を導入してその主要アレルゲンの発現を抑制した組換え体の場合には、大豆が元々持つすべてのアレルゲンについてそれぞれ発現レベルを確認する必要があるが、導入された遺伝子が大豆のアレルゲンの発現に影響を与えるという根拠がないのならば、アレルゲン発現量について確認を行う必要はないからである。
宿主となる作物が元々持つ蛋白質の分析が求められる場合、分析手法としてはイムノブロッティングまたはELISA法(もしくはその両方)が考えられるが[86]、これはアレルギーを起こした記録のない、または症例が限られていて試験用の血清が入手できない食品の場合には適用できないという問題がある。
C. 動物を用いたモデル系
動物を用いたモデル系による実験ではアレルギーのメカニズムを理解するうえで重要な情報を得ることができるが、ある特定の蛋白質が人間に対してアレルゲン性を持つかどうかを評価できるには至っていない。動物モデルの例としては次のようなものがある。
動物モデルは、アレルギーについての基本的な疑問やメカニズムを研究する手がかりとなるため、あるアレルギーが発症した場合にその免疫学的なメカニズムを生物学的または分子学的に解明する研究に用いられてきた[95,96]。しかしこうしたモデルにより導入蛋白質の潜在的アレルゲン性を予測できた例はなく、現段階でこれらのモデルを人間に当てはめることはできない。アレルギー反応は非常に多様である。アレルゲンの種類によって、また、実験に用いた動物の種類やその種の違いによって、さらには同じ動物を用いても時期が異なれば違う反応が起こる[95,96]。このことから、人間のアレルギー発症性を予測できるような信頼性の高い動物モデル系を開発する事がいかに困難かがわかる。
ブラジルナッツの2Sグロブリン蛋白質のアレルゲン性を動物モデルで予測できなかったのはその一例である。この実験では2Sグロブリンをある条件下でマウスに経口投与してその皮膚の即時性アレルゲン性を評価したところ、そのマウスの系統では IgE の反応が起こらなかったため、報告書では「この遺伝子を他の作物に導入すれば、栄養学的な質の改善が期待できる」と結論されている。ただしこうした例は、現在の動物モデルを更に改良することでアレルゲン性をできる系が開発される可能性があることを否定するものではない。
8. 国内および国際的なコンセンサス
本稿での提言は、これまで提案されている提言に矛盾するものではなく、むしろそれらをさらに進めたものだといえる。これまでの主な団体の動きとしては、FDAが1992年に"Food
Policy"文書のなかでアレルゲン性評価のためのガイダンスを提案し、EPAも1994年11月に害虫抵抗性植物に関するガイドラインのドラフトの中でいくつかのガイダンスを提言している。また、FDA,EPA,USDAは遺伝子組換作物のアレルゲン性評価に特に焦点を合わせたシンポジウムを1994年4月に共催している。最近ではOECDとWHOが共催の形でワークショップを行い、そこでもアレルゲン性評価のためのガイダンスが提案された。
9. 今後の展望
遺伝子組換技術は、これまで述べたような問題がある一方、ある種の食品についてはその固有アレルゲン蛋白質のレベルを低減させる有力な手段ともなり得る。例えばアンチセンス遺伝子(蛋白質合成に必要な塩基配列と逆の配列を持つ遺伝子)を導入して、ある遺伝子の発現を抑制することにより、ある特定の蛋白質含有量だけ著しく低減させることが可能である。「フレーバーセーバー」トマトは、この方法でトマトの軟化を引き起こす酵素(ポリガラクチュロナーゼ)の生成を阻害し、日持ち性を向上させたものである。またコメでも、これと同じ手法で最も重要なアレルゲン蛋白を著しく低減させることが行われている。多田らは
16kDa
のアレルゲン蛋白質をコメからクローニングしてそのアンチセンス遺伝子を導入し、組換え体から収穫されたコメの多くでその蛋白質の含有量が著しく減少したと報告している。しかしながらこの蛋白質は完全に除去されたわけではなく、現在更にこのアレルゲン蛋白質レベルを低減させるべく研究が進められている。
この手法により、アレルゲンを持つことが知られている他の作物でも同様にそのアレルゲン蛋白質を選択的に低減または除去する事は可能である。しかしこの手法の問題点として、ピーナッツや大豆などのように複数のアレルゲン蛋白質を持つ作物の場合その応用が複雑になってしまうこと、また、アレルゲン蛋白質が植物体の中で構造的・機能的に重要な役割を果たしているような場合、それを除去することによって植物体が何らかのダメージを受けてしまうことが考えられる。
10. 将来的な研究の課題
アレルゲン性評価手法の開発は、食品アレルゲンに関する物理化学的・免疫学的・生化学的知識が蓄積されて初めて可能になる。評価の正否は、アッセイ法の有効性(例えば擬似消化モデルを用いた系)、免疫学的試験用サンプルの有無(アレルギー食品に含まれる蛋白質の評価を行うのに必要なアレルギー患者の血清)、新たに特定されたアレルゲンについての情報の有無(たとえばアレルゲン蛋白質のアミノ酸配列情報が漸次更新されるデータベース)に左右される。また、有効な動物モデルがあることが望まれる場合もあるかもしれない。
既存のデータベースを拡充していくうえで、新たに特定されたアレルゲン蛋白質のアミノ酸配列と塩基配列(もしくはそのいづれか)のデータは特に食品の場合は貴重な情報であり、同様に主要なB細胞、T細胞のエピトープのマッピング情報も重要である。
また、本稿の提案する物理化学的・生物学的データを、遺伝子組換えで導入される蛋白質を含むアレルゲン/非アレルゲン蛋白の双方について広範に収集することは、ディシジョンツリー評価で用いられる基準の有効性を確立する一助となるだろう。
更に、これまで述べてきた評価手法に関する研究は、血清バンクの充実によってより助長されると考えられる。
今後われわれは、免疫学的疾病が発病する分子学的レベルでの機構(どうしてある食品の蛋白質がアレルゲンになるのか)や、抗原に対し感受性が高くなる原因とアレルギー反応が誘引される要件について、更に理解を深めていく必要がある。そうした研究は、遺伝子工学によって作られる食品の潜在的アレルゲン性評価手法の確立を促進するだけでなく、アレルギーの発症に対処したり未然に防ぐための新たな手法を開発する基盤ともなるだろう。
11. まとめ
本稿は、科学的根拠に基づいて、植物体への遺伝子導入に関連した潜在的アレルゲン性評価のための判断樹評価手法を提案する。
この手法では導入遺伝子の供給体に注目し、それを次の一般的な3つのカテゴリーに分類している。「一般的なアレルギー食品」「一般的ではないアレルギー食品、または非食品でアレルゲン性の知られているもの」「これまでにアレルギー症例の報告されていないもの」遺伝子組換え作物に由来する食品にその遺伝子の供給体を表示すべきかどうかについては、導入された蛋白質について、アミノ酸配列に関する既知アレルゲンとの相同性の程度や
in vitro または in
vivo(もしくはその両方)でのイムノアッセイの結果を、主要な物理化学的性質と併せて検討したうえで勧告がなされることになる。
最終的に遺伝子組換え作物に由来する食品の安全性は、アレルゲン性評価作業を通じて得られるすべてのデータを比較考量して保証される。遺伝子改変により作出された新しい作物は、これまで論じた種々の評価により、交配による育種で何十年もかかって改良された従来の作物と同じ信頼性を獲得した上で、市場に導入されるべきである。





